
【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值. Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离. ①写出硫酸溶液与Fe2O3反应的离子方程式 .
②初步分离得到的滤渣主要成分是 .
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 结合表分析其原因 .
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验. ①氨水使滤液中铝离子沉淀的离子方程式为 .
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是 .
(4)Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3 . 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是 .
2)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整 .
【答案】
(1)6H++Fe2O3=2Fe3++3H2O;SiO2
(2)Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离
(3)3NH3?H2O+Al3+=Al(OH)3+3NH4+;略小于5;铝元素沉淀较多,铁元素还没有开始大量的沉淀 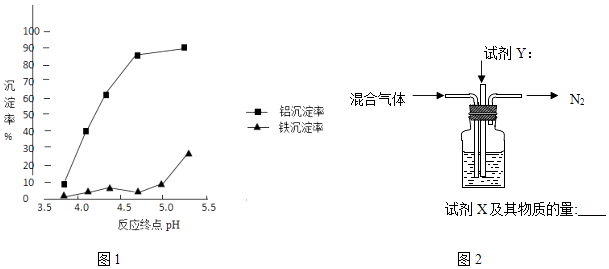
(4)冷却、结晶;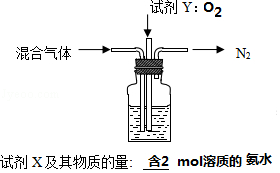
【解析】解:Ⅰ(1)①硫酸溶液与Fe2O3反应的离子方程式为6H++Fe2O3=2Fe3++3H2O,所以答案是:6H++Fe2O3=2Fe3++3H2O;②SiO2不与硫酸反应,则初步分离得到的滤渣主要成分是SiO2 , 所以答案是:SiO2;(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 由表格数据可知,因Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离,所以答案是:Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离;(3)①氨水使滤液中铝离子沉淀的离子方程式为3NH3H2O+Al3+=Al(OH)3+3NH4+ , 所以答案是:3NH3H2O+Al3+=Al(OH)3+3NH4+;②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是略小于5 (或在4.5~5之间均可),因铝元素沉淀较多,铁元素还没有开始大量的沉淀,所以答案是:略小于5;铝元素沉淀较多,铁元素还没有开始大量的沉淀;Ⅱ.(1)由信息可知,溶解度受温度影响大,则将硫酸铝铵与其他溶质分离的方法是冷却、结晶,所以答案是:冷却、结晶;2)加热时发生4NH4Al(SO4)2 ![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,由图可知氮气排出,试剂Y可氧化二氧化硫,试剂X吸收三氧化硫,则试剂Y为O2 , 16mol混合气体含2mol氨气,氧化后由S原子守恒可得到8mol三氧化硫,NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,由8SO3~4NH3 , 则试剂X为含2mol溶质的氨水,所以答案是:
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,由图可知氮气排出,试剂Y可氧化二氧化硫,试剂X吸收三氧化硫,则试剂Y为O2 , 16mol混合气体含2mol氨气,氧化后由S原子守恒可得到8mol三氧化硫,NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,由8SO3~4NH3 , 则试剂X为含2mol溶质的氨水,所以答案是:  .
.


科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质. 已知:①N2(g)+O2(g)═2NO(g)△H1=+180.5kJmol﹣1
②C和C0的燃烧热(△H)分别为﹣393.5kJmol﹣1和﹣283kJmol﹣1
则2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=kJmol﹣1
(2)将0.20mol NO和0.10mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示. ①CO在0﹣9min内的平均反应速率v(CO)=molL﹣1min﹣1(保留两位有效数字);第12min时改变的反应条件可能为 .
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24min时达到平衡状态,CO2的体积分数为(保留三位有效数字),化学平衡常数K=(保留两位有效数字).
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2 . 已知常温下0.1molL﹣1的HCOONa溶液pH=10,则HCOOH的电离常数Ka= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经测定,由C3H7OH、C2H5OC2H5和C6H12组成的混合物中氧的质量分数为8%,则此混合物中氢的质量分数为( )
A. 78%B. 22%C. 14%D. 13%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
A. CH3CH2CH2CH3 B. CH3CH(CH3)2
C. CH3C(CH3)3 D. (CH3)2CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废水中含5.00×10-3mol·L-1的Cr2O72- , 其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程: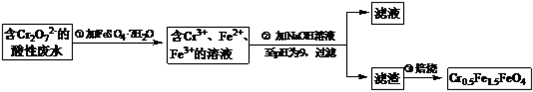
(1)第①步反应的离子方程式是;
(2)第②步中用pH试纸测定溶液pH的操作是:;
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有;
(4)欲使1L该废水中Cr2O72-的完全转化为Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的能源可以分为一次能源和二次能源,一次能源是指直接取自自然界没有经过加工转换的各种能量和资源,由一次能源经过加工转换以后得到的能源产品,称为二次能源。下列叙述正确的是阶段( )
A. 电能是二次能源B. 水力是二次能源
C. 天然气是二次能源D. 水煤气是一次能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能够达到实验目的是( )
A.实验室采用图①所示装置收集SO2
B.用图②所示装置,分离CCl4萃取I2水后的有机层和水层
C.除去NaHCO3溶液中的Na2CO3可加入Ca(OH)2溶液后过滤
D.称取0.40gNaOH,放入100mL容量瓶中,配制0.10molL-1的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同,浓度均为0.1mol/L的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为
A. 4m=n B. m=n C. m<n D. m>n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com