
| A. | 向蛋白质溶液中加饱和硫酸铵溶液,蛋白质析出,如再加水也不溶解 | |
| B. | 蛋白质溶液中蛋白质分子能通过滤纸,但不能通过半透膜 | |
| C. | 浓硝酸溅在皮肤上,能使皮肤呈黄色是由于蛋白质和浓硝酸发生颜色反应 | |
| D. | 重金属盐能使蛋白质变性,吞服钡餐不会引起中毒 |
分析 A、盐析是可逆的,加水可溶解;
B、蛋白质溶液是胶体,胶体能通过滤纸,但不能通过半透膜;
C、皮肤组成重要成分是蛋白质,含有苯环的蛋白质遇浓硝酸发生颜色反应;
D、重金属盐能使蛋白质变性,钡餐的成分是硫酸钡,硫酸钡不溶于酸,无法生成钡离子;
解答 解:A、蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水会溶解,盐析是可逆的,故A错误;
B、蛋白质溶液中蛋白质分子能通过滤纸,不能通过半透膜,故B正确;
C、皮肤组成重要成分是蛋白质,浓硝酸沾到皮肤上能使皮肤变黄,这是由于浓硝酸和含有苯环的蛋白质遇发生了颜色反应,故C正确.
D、重金属盐能使蛋白质变性,钡餐的成分是硫酸钡,硫酸钡不溶于酸,无法生成钡离子,不会引起中毒,故D正确;
故选A.
点评 本题主要考查了蛋白质的性质,应注意蛋白质的盐析是可逆的,而变性是不可逆的,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
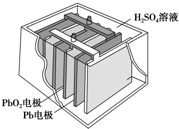 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A. | PbO2是电池的负极 | B. | SO42-向Pb极移动 | ||
| C. | PbO2得电子,被氧化 | D. | 电池放电时,溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③ | B. | 只有④ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
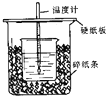 (1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | A | B | C |
| 加入试剂 | KMnO4、H2C2O4 | KMnO4、H2C2O4 1gMnSO4粉末 | KMnO4、H2C2O4 1gNa2SO4粉末 |
| 完全褪色时间/s | 116 | 6 | 117 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
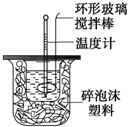 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
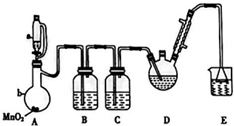 三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:| 物质 | C2H5OH | CCl3CHO | CCl3COOH | C6H5Cl |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,16g14CH4所含中子数数目为8NA | |
| C. | 15.6gNa2O2和水完全反应转移的电子数为0.2NA | |
| D. | 0.1L3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物,都能发生水解反应 | |
| B. | 蔗糖和葡萄糖不是同分异构体,但属同系物 | |
| C. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| D. | 石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com