
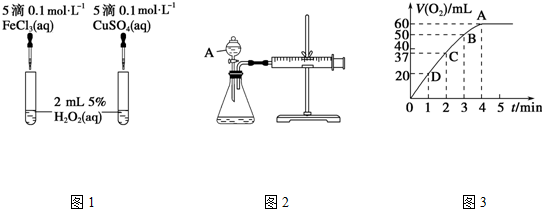
���� ��1���ȽϷ�Ӧ���ʵĴ�С��ͨ���������ݵĿ������жϣ��ȽϽ��������ӵĴ�Ч��Ҫ�ų������ӵĸ��ţ�A���������Ƿ�Һ©��������װ�������Եķ����ǣ��رշ�Һ©���Ļ�������ע����������������һ�Σ���һ������Ƿ�ص�ԭλ���÷�Ӧ��ͨ����Ӧ���ʷ����ģ����Ը���v=$\frac{��c}{��t}$������
��2�����ŷ�Ӧ�Ľ��У���Һ��Ũ�����ͣ���Ӧ������С������ͼ����Կ���H2O2��ȫ��Ӧ�ų�60 mL O2������2H2O2$\frac{\underline{\;����\;}}{\;}$2H2O+O2�����м��㣻
��3������2H2O2$\frac{\underline{\;����\;}}{\;}$2H2O+O2����v=$\frac{��c}{��t}$���м��㣮
��� �⣺��1���÷�Ӧ�в������壬�ɸ����������ݵĿ����жϣ��Ȼ���������ͭ���������Ӷ���ͬ�����ж��������������û��������������ã������ƺ�����ͭ��������ͬ���������������Ӳ�ͬ��ʵ��ĸ��ţ��ڶ������������������£�˫��ˮ�ֽ�����ˮ����������Ӧ����ʽΪ��2H2O2$\frac{\underline{\;����\;}}{\;}$2H2O+O2����A���������Ƿ�Һ©��������װ�������Եķ����ǣ��رշ�Һ©���Ļ�������ע����������������һ�Σ���һ������Ƿ�ص�ԭλ��������ָ�ԭλ����֤�����������ã����ã�����v=$\frac{��c}{��t}$֪������Ҫ�ⶨ����40mL���������ʱ�䣬
�ʴ�Ϊ���������ݵĿ��������������Ӳ�ͬ��ʵ��ĸ��ţ�2H2O2$\frac{\underline{\;����\;}}{\;}$2H2O+O2������Һ©��������40mL���������ʱ�䣻
��2���ڶ������������������£�˫��ˮ�ֽ�����ˮ����������Ӧ����ʽΪ��2H2O2$\frac{\underline{\;����\;}}{\;}$2H2O+O2����Ũ��Խ��Ӧ����Խ��֮ԽС�����ŷ�Ӧ���У���Ӧ���Ũ����С����������С������ͼ����Կ���H2O2��ȫ��Ӧ�ų�60 mL O2��H2O2�ķֽⷴӦΪ2H2O2$\frac{\underline{\;����\;}}{\;}$2H2O+O2������n��H2O2��=$\frac{0.06}{22.4}$��2��0.00536 mol��
c��H2O2��=$\frac{0.00536}{0.05}$��0.11 mol/L���ʴ�Ϊ�����ŷ�Ӧ�Ľ��У�Ũ�ȼ�С����Ӧ���ʼ�����0.11 mol/L��
��3��Zn+2H+=Zn2++H2
65g 1mol 1mol 22.4L
6.5g 0.1mol 0.1mol 0.0448L
�������ʾ10s�ڸ÷�Ӧ������Ϊv=$\frac{\frac{0.1}{0.04}}{10}$=0.25mol•L-1•s-1���ʴ�Ϊ��0.25��
���� ���⿼��ʵ�鷽����ƣ�����v=$\frac{��c}{��t}$�����ʵ�飬ͨ���õ�����������ʱ��Ĺ�ϵȷ��Ӱ�췴Ӧ���ʵ����أ��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��3���ڢ�A�� | B�� | ��3���ڢ�B�� | C�� | ��3���ڢ�B�� | D�� | ��3���ڢ�A�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
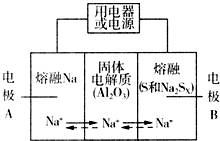 �����������ڽ���Na������S�Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ����ͼ��ʾ��
�����������ڽ���Na������S�Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ����ͼ��ʾ��| ���� | Na | S | Al2O3 |
| �۵�/�� | 97.8 | 115 | 2050 |
| �е�/�� | 892 | 444.6 | 2980 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| X | |
| Y | Z |
 ��U2X�ĵ���ʽ
��U2X�ĵ���ʽ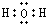
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | A | B | C | D |
| �������� | �⻯�� | �ɱ� | ʯī | �� |
| ������ ������ | ���������� | ���� | ԭ�� | ���� |
| ���Ӽ� ������ | ���Ӽ� | ���Ӽ� ������ | ���ۼ� | ���Ӽ� ������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬ���칹�� | B�� | ͬ�������� | C�� | ͬλ�� | D�� | ͬϵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ������顢������ | B�� | �������Ȼ�̼����ϩ | ||
| C�� | �����ױ��������� | D�� | �״����������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��д����ӦX+Y�����Ȼ�ѧ����ʽ��C��s��+$\frac{1}{2}$O2��g��=CO��g����H=-110.6KJ/mol��
��д����ӦX+Y�����Ȼ�ѧ����ʽ��C��s��+$\frac{1}{2}$O2��g��=CO��g����H=-110.6KJ/mol��
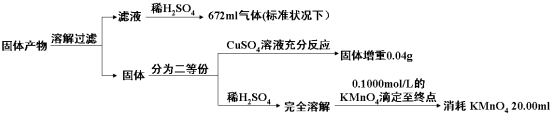
| ��������еijɷ� | K2AB3 | �� | ||
| ���ʵ���֮�� | ||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com