
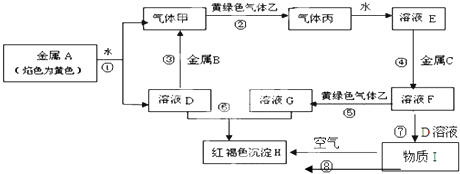
分析 金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C为Fe,F为FeCl2,G为FeCl3,氯化亚铁与氢氧化钠反应生成I为Fe(OH)2,氢氧化亚铁在空气中被氧化成氢氧化铁,符合各物质的转化关系,据此答题;
解答 解:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C为Fe,F为FeCl2,G为FeCl3,氯化亚铁与氢氧化钠反应生成I为Fe(OH)2,氢氧化亚铁在空气中被氧化成氢氧化铁,
(1)根据上面的分析可知,金属A的化学式为Na,
故答案为:Na;
(2)G为FeCl3,实验室检验G中所含的铁离子时,常用KSCN溶液,溶液呈血红色,
故答案为:KSCN;
(3)反应④为盐酸与铁的反应生成氯化亚铁和氢气,反应的离子方程式为Fe+2H+═Fe2++2H2 ↑,
故答案为:Fe+2H+═Fe2++2H2 ↑;
(4)反应⑧为氢氧化亚铁在空气中被氧化成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 .
点评 本题是考查物质推断与性质、常用化学用语,难度中等,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 已溶解的溶质和未溶解的溶质质量相等 | |
| B. | 溶质不再溶解,因此从表面看溶质不再减少,也不再增加 | |
| C. | 升高温度,饱和溶液将变为不饱和溶液 | |
| D. | 溶质的溶解和结晶继续进行,且速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应 Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | 氢氧化钡溶液与硫酸溶液反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | CO2通入过量澄清石灰水 CO2+Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝:治疗胃酸过多的一种药剂 | |
| B. | 明矾:净水剂 | |
| C. | 烧碱:治疗胃酸过多的一种药剂 | |
| D. | 小苏打:发酵粉主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 1.0mol | C. | 1.5mol | D. | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
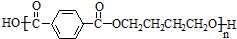
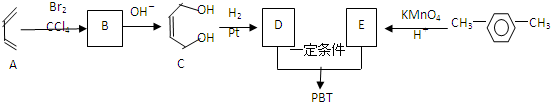
 互为同系物关系.
互为同系物关系.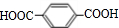 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$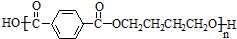 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com