
【题目】某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)等,一种综合利用工艺设计如下:
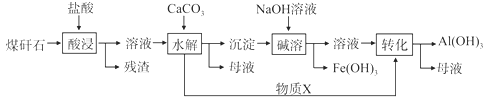
(1)物质X的化学式为__________________
(2)“酸浸”过程中主要反应的离子方程式为:________________,________________
(3)“碱溶”的目的是___________________
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:_________________________
【答案】CO2 Al2O3+6H+=2Al3++3H2O Fe2O3+6H+=2Fe3++3H2O 将Al(OH)3转化为AlO2-,以便和Fe(OH)3分离 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】
含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,过滤,沉淀中加入氢氧化钠,氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝,所以物质X为CO2。
(1)根据以上分析可知物质X的化学式为CO2;
答案: CO2
(2)由以上分析可知,“酸浸”过程中主要反应的离子方程式为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;
答案:Al2O3+6H+=2Al3++3H2O Fe2O3+6H+=2Fe3++3H2O。
(3)沉淀为氢氧化铁、氢氧化铝,过滤,沉淀中加入氢氧化钠,氢氧化铝溶解,与氢氧化铁分离,Al(OH)3+OH-=AlO2-+2H2O;
答案: 将Al(OH)3转化为AlO2-,以便和Fe(OH)3分离
(4)三步法书写离子方程式:①根据化合价升降相等配平化合价发生变化的元素②根据左右两边电荷守恒填写H+或OH-,由于是碱性环境所以填写的是OH③根据所有两边原子守恒填写水。该反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
答案:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。


科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。经质谱法测得该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗O2的质量是多少______?
(2)求此化合物的分子式______。
(3)经红外光谱分析,该化合物分子中存在苯环和羟基,试写出其可能的结构简式______。
(4)进一步实验表明,该化合物的核磁共振氢谱存在四个峰,且峰面积之比为1:2:2:3,试确定该化合物的结构简式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)
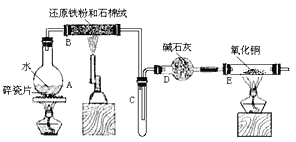
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作是 ________________。 装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C中玻璃管处点燃该气体,则必须对该气体行________________,装置E中的现象是 _______________________________________
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 _____________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
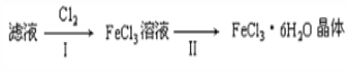
① 步骤I中通入Cl2的作用是__________________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
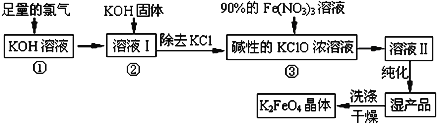
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2 =5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)的情况下进行;
(2)在溶液I中加入KOH固体的目的是________(填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为________________________________________ 。
(4)如何判断K2FeO4晶体已经洗涤干净________________________________。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A,C同周期,B,C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:A:________、B:________、C:________、D:________、E:________。
(2)用电子式表示离子化合物A2B的形成过程:______________________。
(3)写出下列物质的电子式:
①D元素形成的单质:_______________________________________________。
②E与B形成的化合物:_____________________________________________。
③A,B,E形成的化合物:___________________________________________。
④D与E形成的化合物:______________________________________________。
⑤C,D,E形成的离子化合物:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为( )
A. 用稀盐酸除去水垢:2H++CaCO3===Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS===H2S↑+Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-===Al2(CO3)3↓
D. Na2O2溶于水产生O2∶Na2O2+H2O===2Na++2OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对乙烯基苯甲酸是重要的医药中间体,广泛应用于合成感光材料。对乙烯基苯甲酸可通过如下反应合成。
反应①: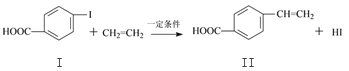
(1)下列关于化合物I和化合物Ⅱ的说法,正确的是______________。
a.化合物I能与新制的Cu(OH)2反应 b.均可发生酯化反应和银镜反应
c.化合物Ⅱ能使KMnO4溶液褪色 d.1 mol化合物Ⅱ最多能与5 mol H2反应
(2)化合物Ⅱ在催化剂条件下生成高分子化合物的反应方程式为_____________。
(3)化合物Ⅱ可由芳香族化合物Ⅲ通过消去反应获得,Ⅲ和Cu共热的产物能发生银镜反应,写出化合物Ⅲ的结构简式__________________________。
(4)化合物Ⅳ是化合物Ⅱ的同分异构体,且化合物Ⅳ遇FeCl3溶液显紫色,苯环上的一氯代物只有2种,写出化合物Ⅳ的结构简式________________________(写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使宇航员在飞船中得到一个稳定的,良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 ( )
A. Na2O2中阴、阳离子的个数比为1∶1
B. Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C. Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D. Na2O2的漂白原理与SO2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)求:
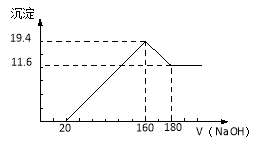
(1)合金中Mg的质量.
(2)所用HCl的物质的量浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com