
| A. | 氨气可做制冷剂 | |
| B. | 氧化铝可做耐火材料 | |
| C. | 晶体硅可用于制造光导纤维 | |
| D. | 过氧化钠可用于呼吸面具,提供氧气 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 离子半径:W3+>Y2- | ||
| C. | 原子序数:X+M>Y+W | D. | 单质沸点:M>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述不正确的是( )
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述不正确的是( )| A. | H+从负极区通过交换膜移向正极区 | |
| B. | 正极的电极反应式为:O2+H2O+4e-═4OH- | |
| C. | 图中a、b、c、d物质分别是CO2、CH2OH、H2O | |
| D. | 用该燃料电池电解饱和食盐水,产生1.5mol氯气,需要消耗甲醇16克 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
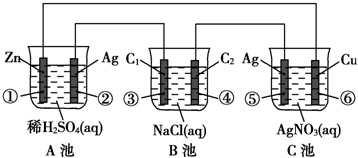
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com