
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_________;
(2)写出“反应”步骤中生成ClO2的化学方程式________________________;
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、_______________;
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应中,氧化剂与还原剂的物质的量之比为__________________,该反应中氧化产物是_________________。
【答案】+3价 2NaClO3+SO2+H2SO4= ClO2↑ + 2NaHSO4 NaOH溶液 Na2CO3溶液 2:1 O2
【解析】
(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3价。
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,根据电子守恒和原子守恒,反应的化学方程式为2NaClO3+SO2+H2SO4= ClO2↑ + 2NaHSO4。
(3)食盐溶液中混有Mg2+和Ca2+,可用过量NaOH溶液除去Mg2+,用过量Na2CO3溶液除去Ca2+;
(4)由图可知:利用含有过氧化氢的NaOH溶液吸收ClO2气体,产物为NaClO3,则氧化剂为ClO2,还原产物为NaClO2,还原剂为H2O2,氧化产物为O2,每1mol的H2O2转移2mol电子,反应方程式是:2NaOH+2ClO2+H2O2=2NaClO2+O2+2H2O,所以氧化剂和还原剂的物质的量之比为2:1,该反应中氧化产物O2。


科目:高中化学 来源: 题型:
【题目】把2mol X气体和1mol Y气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g),2min内生成0.4mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.2mol·L-1·min-1,试计算:
(1)前2min内,用X表示的平均反应速率______;
(2)化学方程式中Z的化学计量数n______;
(3)2min内Y的转化率______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在有机化合物中,每个碳原子周围都有4对共用电子对
B.在有机化合物中,碳原子能形成单键、双键、叁键,还可形成其它形式的共价键
C.在有机化合物中,碳、氢原子之间只能形成单键
D.在有机化合物中,碳、氮原子之间只能形成单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:

下列说法正确的是
A. 过程Ⅰ、过程Ⅲ均为放热过程
B. 过程Ⅲ生成了具有极性共价键的H2、CO2
C. 使用催化剂降低了水煤气变换反应的ΔH
D. 图示过程中的H2O均参与了反应过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
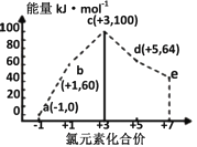
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量的叙述不正确的是( )
A.物质的量是国际单位制中七个基本物理量之一
B.物质的量是表示物质所含微观粒子多少的一个物理量
C.物质的量常用符号n表示,其单位是摩尔(mol)
D.物质的量可用来表示物质的质量和数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是 ___________________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇燃烧的热化学方程式为____________________________________________________________。
(3)由于C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJmol1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
(4)关于用水制取二次能源氢气,以下研究方向不正确的是________________
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(5)已知下列两个热化学方程式:
A、2H2(g)+O2(g) ===2H2O(l) △H=-571.6 kJmol-1 B、C3H8(g)+5O2(g) ===3CO2(g)+4 H2O(l) △H=-2 220 kJmol-1,其中,能表示燃烧热的热化学方程式为___________(A或B),其燃烧热为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
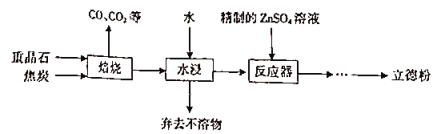
(1)焙烧(温度为1000~2000)时,焦炭需过量,其目的是____________________。
(2)焙烧过程中发生的反应之一是4CO+BaSO4![]() BaS+4CO2,该反应的氧化剂与还原剂的物质的量之比为_________________,还原产物是___________。
BaS+4CO2,该反应的氧化剂与还原剂的物质的量之比为_________________,还原产物是___________。
(3)反应器中发生反应的化学方程式为______________________。
(4)流程中所需的精制的ZnsO,溶液的制取方法是:首先用工业级氧化锌(含少量FeO和Fe2O3杂质)和稀硫酸反应制取粗硫酸锌溶液,然后向粗硫酸锌溶液中先后加入H2O2溶液和碳酸锌精制。
①加入H2O2溶液时发生反应的离子方程式为______________________。
②加入碳酸锌的目的是________________,反应的化学方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com