
【题目】在体积恒定的密闭容器中,1 mol A(g)与1 mol B(g)在催化剂作用下加热到500 ℃发生反应:A(g)+nB(g)![]() C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
A.升高温度v(正)增大,v(逆)减小,平衡向正反应方向移动
B.平衡后再加入1 mol B,上述反应的ΔH增大
C.当n<1时,通入惰性气体,压强增大,平衡向逆反应方向移动
D.若n=1且A的转化率为50%,则平衡常数等于1
【答案】D
【解析】
A.升高温度,化学反应速率加快,v(正)增大,v(逆)也增大,化学平衡向吸热的正反应方向移动,A错误;
B.增加反应物B的量,反应物浓度增大,会使化学平衡正向移动,但是该反应的△H不变,B错误;
C.通入惰性气体,由于反应容器的容积不变,各组分的浓度不变,化学平衡不移动,C错误;
D.对于反应A(g)+nB(g)![]() C(g)+D(g) ΔH>0 假设反应容器的溶解为1 L,则反应开始时c(A)=c(B)=1 mol/L,c(C)=c(D)=0,由于A的转化率为50%,则平衡时c(A)=c(B)=(1 -0.5)mol/L=0.5 mol/L,c(C)=c(D)=0.5 mol/L,所以化学平衡常数K=
C(g)+D(g) ΔH>0 假设反应容器的溶解为1 L,则反应开始时c(A)=c(B)=1 mol/L,c(C)=c(D)=0,由于A的转化率为50%,则平衡时c(A)=c(B)=(1 -0.5)mol/L=0.5 mol/L,c(C)=c(D)=0.5 mol/L,所以化学平衡常数K=![]() =
=![]() =1,D正确;
=1,D正确;
故合理选项是D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向 0.1mol/LNa2A溶液中不断通入HCl。H2A、HA-、A2-在溶液中所占物质的量分数与 pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是( )

A. H2A的第二级电离平衡常数为10-10
B. 随着HCl的通入 c(H+)/c(H2A)先减小后增大
C. 当溶液呈中性时:c(Na+)=c(HA-)+2c(A2-)
D. 将等浓度等体积的 Na2A与H2A溶液混合后,溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置和其他必要的仪器用品,完成下列实验。

已知2NH3+3CuO![]() N2+3Cu+3H2O,该实验证明氨气具有还原性。
N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是______________________。
(3)硬质玻璃管中可观察到的实验现象是_________________________________。
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )
A.将![]() 的
的![]() 溶液与
溶液与![]() 溶液充分混合,若混合后溶液的体积为10mL,则混合液的
溶液充分混合,若混合后溶液的体积为10mL,则混合液的![]()
B.将![]() 的某一元酸HA溶液和
的某一元酸HA溶液和![]() 溶液等体积混合,混合液pH大于7,则反应后的混合液中:
溶液等体积混合,混合液pH大于7,则反应后的混合液中:![]()
C.pH相等的![]()
![]()
![]() 溶液中,
溶液中,![]() 大小关系:
大小关系:![]()
D.常温下,![]() 的
的![]() 和NaClO的混合溶液中:
和NaClO的混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)Co 属于元素周期表中______区元素,其基态原子的价电子排布式为______。
(2)基态Na原子中,核外电子占据的原子轨道总数为______,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由小到大的顺序为______(用元素符号表示)。
(4)ClO4 -的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为______,1mol碳酸丙烯酯中![]() 键的数目为______。
键的数目为______。
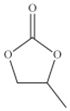
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是______,该配离子包含的作用力为______(填选项字母)。
A.离子键B.金属键C.配位键D.氢键E.极性键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为______nm(用含ρ、NA的代数式表示)。
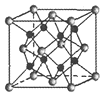
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图展示了近代化学发展的几个重要里程碑。下列说法正确的是( )

A.1661年波义耳提出了元素的概念并发现了同位素
B.1774年拉瓦锡提出燃烧的氧化学说并揭示了氧化还原反应的本质
C.1803年道尔顿提出原子学说并揭示了原子构成的奥秘
D.1869年门捷列夫发现了元素周期律并制成了第一张元素周期表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该HCl溶液用该NaOH溶液中和,需Vb L NaOH溶液,问:
(1)若a+b=14,则Va∶Vb=___。
(2)若a+b=13,则Va∶Vb=___。
(3)若a+b>14,则Va∶Vb=___,且Va___Vb(填“>”“<”或“=”)。
(4).25 ℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。(书写步骤)
①若所得溶液的pH=11,且a=13,b=2,则Va∶Vb=________。
②若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b的值可否等于4________(填“可以”或“否”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com