
下列表示水解的离子方程式正确的是( )
|
| A. | CH3COO﹣+H2O⇌CH3COOH+OH﹣ | B. | NH4++H2O⇌NH4OH+H+ |
|
| C. | S2﹣+2H2O⇌H2S+2OH﹣ | D. | HCO3﹣+H2O⇌H3O++CO32﹣ |
考点:
离子方程式的书写.
分析:
A.醋酸根水解显碱性CH3COO﹣+H2O⇌CH3COOH+OH﹣;
B.铵根离子水解显酸性,水解离子反应为NH4++H2O⇌NH3.H2O+H+;
C.S2﹣分步水解;
D.HCO3﹣水解显碱性,离子方程式为HCO3﹣+H2O⇌OH﹣+H2CO3.
解答:
解:A.醋酸根水解显碱性CH3COO﹣+H2O⇌CH3COOH+OH﹣,故A正确;
B.铵根离子水解显酸性,水解离子反应为NH4++H2O⇌NH3.H2O+H+,故B错误;
C.S2﹣分步水解,S2﹣+H2O⇌HS﹣+OH﹣,故C错误;
D.HCO3﹣水解显碱性,离子方程式为HCO3﹣+H2O⇌OH﹣+H2CO3,故D错误;
故选A.
点评:
本题考查离子反应方程式的书写,侧重电离与水解离子反应的考查,注意弱电解质的电离及盐类水解为可逆反应,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列各关系式中能说明反应N2+3H2⇌2NH3已达到平衡状态的是( )
|
| A. | 3υ正(N2)=υ正(H2) | B. | υ正(N2)=υ逆(NH3) |
|
| C. | υ正(N2)=3υ逆(H2) | D. | 2υ正(H2)=3υ逆(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸碱指示剂是一种有机弱酸,其在水溶液中的电离平衡与其呈颜色有关:HIn(红色)⇌H++In﹣(黄色),若向含此指示剂的溶液中加入盐酸,溶液呈 色.若向此溶液中加入氢氧钠,溶液呈 色.
查看答案和解析>>
科目:高中化学 来源: 题型:
关于强弱电解质及非电解质的组合完全正确的是( )
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | 氨水 | HClO | HI |
| 非电解质 | Cl2 | 蔗糖 | C2H5OH | SO2 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,某溶液中由水电离出的c(OH﹣)=10﹣5 mol•L﹣1,则其溶质可能是( )
|
| A. | CH3COOH | B. | H2SO4 | C. | NaOH | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
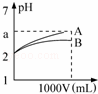
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
①a=5时,A是强酸,B是弱酸;
②若A、B都是弱酸,则5>a>2;
③稀释后,A酸溶液的酸性比B酸溶液强;
④A、B两种酸溶液的物质的量浓度一定相等.
|
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,反应SO2(g)+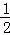 O2(g)⇌SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)⇌2SO2(g)+O2(g)的平衡常数K2的值为( )
O2(g)⇌SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)⇌2SO2(g)+O2(g)的平衡常数K2的值为( )
|
| A. | 2500 | B. | 100 | C. | 4×10﹣4 | D. | 2×10﹣2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为 mol。
②d反应的离子方程式为 。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如图-2。
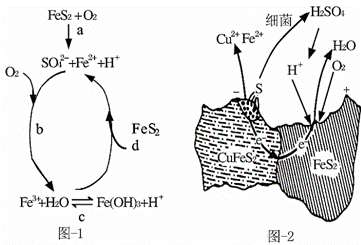
①冶炼过程中,正极周围溶液的pH (填“增大”、“减小”或“不变”)。
②负极产生单质硫的电极反应式为 。
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数的对数值与温度的关系如图-3。
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s) + H2(g) | ΔH1 | K1 |
| 1/2 FeS2(s) + H2(g) | ΔH2 | K2 |
| FeS(s) + H2(g) | ΔH3 | K3 |
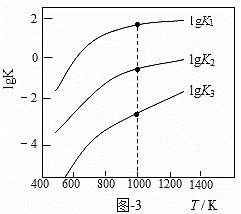
①上述反应中,ΔH1 0(填“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com