
下列变化中,属于吸热过程的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气
⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.①②④
科目:高中化学 来源: 题型:
某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
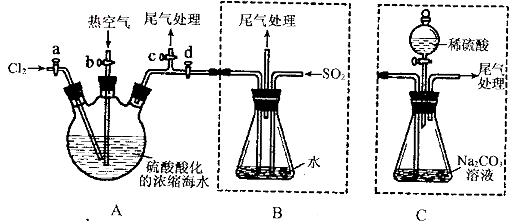
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2:
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)实验室中常用来制备氯气的化学方程式为__________________________;
(2)步骤②中鼓入热空气的作用为_____________________________;
(3)步骤B中发生的主要反应的离子方程式为______________________________。
(4)此实验中尾气可用 (填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液
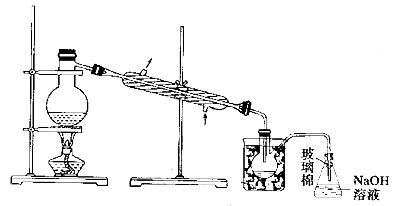
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。
(7)与B装置相比,采用C装置的优点为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(白磷,s)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1①
P(红磷,s)+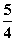 O2(g)===
O2(g)===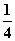 P4O10(s) ΔH2=-738.5 kJ·mol-1②
P4O10(s) ΔH2=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为____________________________。相同状况下,能量状态较低的是________;白磷的稳定性比红磷________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧热是指1 mol可燃物充分燃烧生成稳定氧化物时放出的热量。已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ·mol-1、-1 411.0 kJ·mol-1和-1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2 kJ·mol-1 B.44.2 kJ·mol-1
C.-330 kJ·mol-1 D.330 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
2H2O(l)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
当1 g液态水变为气态水时,对其热量变化的下列描述:①放热;②吸热;③2.44 kJ;
④4.88 kJ;⑤88 kJ。其中正确的是( )
A.②和⑤ B.①和③ C.②和④ D.②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1的稀H2SO4中,乙同学将电极放入6
mol·L-1的NaOH溶液中,如图所示。
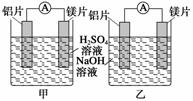
(1)写出甲池中发生的有关电极反应的反应式:
负极_______________________________________________________________,
正极_______________________________________________________________。
(2)写出乙池中发生的有关电极反应的反应式:
负极________________________________________________________________,
正极________________________________________________________________。
总反应离子方程式为__________________________________________________。
(3)如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些结论?________。
A.利用原电池反应判断金属活动性顺序应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应条件多变,应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
光气(COCl2)在塑料、制革、制药 等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为____________________________;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和
-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为______________;
(3)COCl2的分解反应为COCl2(g)====Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未表示出):
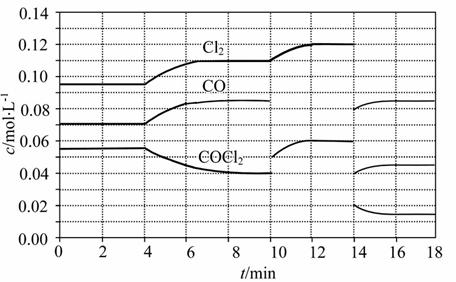
①计算反应在第8 min时的平衡常数K=__________;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)_____
T(8)(填“<”“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________
___ mol·L-1;
④比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6)_____v(15~16)(填“<”“>”或“=”),原因是______________
_________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com