
【题目】如图是一个电化学过程的示意图,请按要求回答下列问题
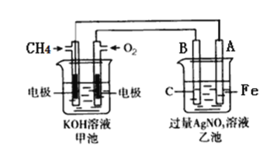
(1)甲池是_______装置(填“原电池”或“电解池”)
(2)写出电极反应式:通入CH4的电极________;A(Fe)电极_______。
(3)反应一段时间后,甲池中消耗1.6g甲烷,则乙池中某电极的质量增加_____g。
(4)反应一段时间后,乙池中溶液成分发生了变化,想要完全恢复到电解前可加入的物质是____
(5)某工厂烟气中主要含SO2,可用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。

①图中a极要连接电源的______(填“正”或“负”)极,C口流出的物质是______。
②SO32-放电的电极反应式为______。
【答案】原电池 CH4-8e-+10OH-=CO32-+ 7H2O Ag++e-=Ag 86.4g Ag2O 负 较浓的硫酸 SO32--2e-= SO42-+2H+
【解析】
(1)甲池是燃料电池,将化学能转化为电能,属于原电池;
(2)燃料电池中甲烷失电子,发生氧化反应,注意还要考虑电解质的后续反应,故电极反应式为:CH4-8e-+10OH- =CO32-+ 7H2O,铁与电源负极相连作阴极,溶液中银离子在阴极A得电子发生还原反应,电极反应式为:Ag++e- =Ag;
(3)甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4-8e-+10OH-=CO32-+ 7H2O,消耗1.6g甲烷的物质的量为0.1mol,转移电子0.8mol,根据Ag++e-=Ag,乙池阴极增重银的质量为:0.8mol×108g/mol=86.4g;
(4)乙池电池反应式为4AgNO3+2H2O=4Ag+O2↑+4HNO3,向溶液中加入氧化银,氧化银与硝酸反应又生成硝酸银和水,可使溶液恢复到电解前的状况;
(5)①由图可知,Na+移向a极,所以a极为阴极,连接电源负极,b极为阳极,连接电源负极,SO32-失电子,发生氧化反应生成SO42-,所以C口流出较浓的硫酸;
②SO32-在阳极放电,发生氧化反应生成硫酸根,电极反应式为:SO32--2e-= SO42-+2H+。


科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是![]()
选项 | 已知 | 解释与结论 |
A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
B |
该反应在常温下能自发进行 | 该反应的 |
C | 常温下,
| 向 |
D | 向 | 氧化性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关甲、乙、丙、丁四个图示的叙述正确的是( )
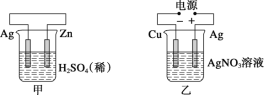
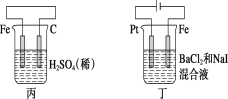
A.甲中负极反应式为2H++2e-=H2↑
B.乙中阳极反应式为Ag++e-=Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀有金属铟由于其良好的性能常用于生产液晶显示器和平板屏幕,下图是铟元素的相关信息,下列有关铟的说法错误的是
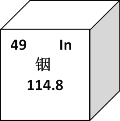
A. 115In原子核内有66个中子
B. 115In原子核外有49个电子
C. 115In、113In互为同位素
D. 115In、113In的化学性质有较大的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为常见的有机物,它们之间有如下转化关系。已知:①A是一种植物生长调节剂,有催熟作用;②醛基在氧气中易被氧化成羧基。回答下列问题: 
(1)A和B中官能团名称分别是_______和_______。
(2)在F的众多同系物中:含6个碳原子的同系物其同分异构体有_______种
(3)反应⑥和⑦均可得到G,要制备得到较纯净的G,应该选用反应_________。
(4)反应①﹣⑦属取代反应的有_______;反应④中,浓硫酸的作用是___________________。银氨溶液与C反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
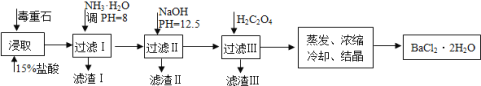
(1)写出“浸取”环节发生的主要离子方程式______。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的______。(双选,填选项字母)
a.烧杯b.容量瓶c.滴定管d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
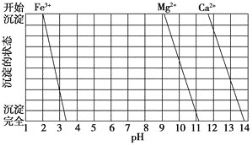
已知:Ksp(BaC2O4)= 1.6×10-7, Ksp(CaC2O4)= 2.3×10-9,
①滤渣I中含_____(填化学式)。再加入NaOH调节pH=12.5可除去______(填离子符号)
②加入H2C2O4应避免过量的原因是________
(3)25℃,H2C2O4的电离平衡常数如下:
H2C2O4 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
①HC2O4-的电离平衡常数表达式Ka2=__________
②NaHC2O4溶液呈_______(酸性、碱性、中性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4 LSO2和SO3混合物中含有的硫原子数目为0.1NA
B.氢氧燃料电池负极消耗1.12L气体时,电路中转移的电子数为0.1NA
C.1mol NaHSO4在熔融状态下电离出的阳离子数为0.2NA
D.在1L 0.5mol/L的Na2CO3溶液中,阴离子总数大于0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是( )
A.升温不利于正反应生成Ni(CO)4(g)
B.在25 ℃时,反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正>v逆
D.在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com