
����Ŀ����������CO2����ͨ��KOH��Ba��OH��2��KAlO2�Ļ����Һ�У����ɳ��������ʵ�������ͨ��CO2�������ϵ��ͼ��ʾ�����й���������Ӧ�����е���������ȷ���ǣ� ��

A. AOa�η�Ӧ�Ļ�ѧ����ʽ��Ba��OH��2+CO2�TBaCO3��+H2O
B. ab����cd���������ķ�Ӧ��ͬ
C. de�γ�������������BaCO3������ʧ��
D. bc�η�Ӧ�����ӷ���ʽ��2AlO2��+3H2O+CO2�T2Al��OH��3��+CO32-
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ������ȤС��Ϊ̽��ͭ��Ũ���ᷴӦ��������������������ͼ��ʾ��װ�ý���ʵ����

��ش�����������
(1)����X������Ϊ_________��
(2)Y��Һ������________����Ӧ��ʵ��������____________________________________________________��
(3)��װ�õ�������______________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������̷�Һ����Ҫ��Mn2+��H+��SO42-������������Cl-��Zn2+��Cu2+����ȡ�����̵��������£�

��1������I����Ҫ�ɷ���CuCl����ʪ�������ױ���������������I����ʱ�䲻�˹�������ԭ����_____________�������ӷ���ʽ��ʾ����
��2��������I��������Һ��Zn2+��Cu2+��Ũ�Ⱦ�Ϊ0.01mol/L������(NH4)2S��Һ��������CuS��������Ksp(ZnS)_______Ksp(CuS)���>����<��������п��ͭʱ�������ҺpH, pH���ͣ��������ӳ�������ȫ��ԭ����_____________��
��3��д���������з�����Ӧ�Ļ�ѧ����ʽ��_______��������ȥ�����̷�Һ�е�Cu2+��Zn2+��Cl-������ʱ�ᵼ��____________��
��4����CuCl�����м���һ������NaCl��Һ����Ӧ�����и����ӵ����ʵ�����ʱ��仯��ͼ��ʾ��д���÷�Ӧ�����е����ӷ���ʽ��____________��X�ö�Ӧ���ӵĻ�ѧʽ��ʾ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1����CH3CH2CH2CH20H��������Ũ���������£�ͨ��������Ӧ�Ƶ����ᶡ������Ӧ�¶�Ϊ115��125 ������Ӧװ����ͼ�����жԸ�ʵ��������������

A. ������ˮԡ����
B. ����������������������
C. 1�����������ܷ�Ӧ�������һ����������
D. �����������������1������ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�㷺��ij��������Ҫ�ɷ���NiFe2O4������������NiO��FeO��
CaO��SiO2�ȣ������ǴӸÿ����л���NiSO4�Ĺ���·�ߣ�
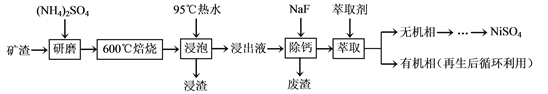
��֪��(NH4)2SO4��350�����ϻ�ֽ�����NH3��H2SO4��NiFe2O4�ڱ��չ���������
NiSO4��Fe2(SO4)3��
����Sn��λ�ڵ������ڵڢ�A�塣
��1������ǰ��������(NH4)2SO4�����ĥ�������ĥ��Ŀ����___________________��
��2�������ݡ�������Fe2(SO4)3����FeO(OH)�����ӷ���ʽΪ____________________��
���������ijɷֳ�Fe2O3��FeO(OH)�����________���ѧʽ����
��3��Ϊ��֤��Ʒ���ȣ�Ҫ��⡰����Һ������������ȡһ������Ľ���Һ���������ữ����SnCl2��Fe3+��ԭΪFe2+������SnCl2�����ʵ���������Fe3+���ʵ�����_______������ȥ������SnCl2����������K2Cr2O7����Һ�ζ���Һ�е�Fe2+����ԭ����ΪCr3+���ζ�ʱ��Ӧ�����ӷ���ʽΪ___________________��
��4��������Һ����c(Ca2+) = 1.0��10��3mol��L��1���������ʴﵽ99%ʱ����Һ��c(F��) = ________mol��L��1��[��֪Ksp (CaF2)=4.0��10��11]
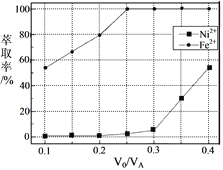
��5���������У���ȡ������Һ������ȣ�V0/VA������Һ��Ni2+��Fe2+����ȡ��Ӱ������ͼ��ʾ��V0/VA�����ȡֵ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪ���ֶ�����Ԫ�أ����ǵ�����������Ӧˮ����ֱ�Ϊ�ס��ҡ��������������¼ס��������������ҷ�Ӧ�����κ�ˮ��X��Z��W��ԭ��������0.1 mol��L�ס���������Һ��pH��ͼ��ʾ(��֪lg2=0.3)������˵����ȷ����

A. �������ӵĻ�ԭ�ԣ�Z<W
B. X��Y�ֱ���W�γɵĻ������Ϊ���ӻ�����
C. �ҹ����м������Һ��Ũ��ˮ�����嶼���ܽ�
D. Y��Z�ļ����Ӷ���Ӱ��ˮ�ĵ���ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ཡ�������봶�ߣ�����Ҫԭ�� ��
A.�۸���ˣ���������B.����������ɫ�������Ժ�
C.��⿵�ʳ��������������Ҫ����Ԫ��D.���������������ܺ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����ڻ�ѧ��Ӧ�жϼ���λ�ã�����ȷ��������ṹ���жϷ�Ӧ���͡��л���A��ֻ����C��H��O����Ԫ�أ��������ģ�����£�

��1��A�ķ���ʽΪ_______��д��̼ԭ������A�ٵ�A��һ��ͬϵ��Ľṹ��ʽ____��
��2����ҵ�в�ȡϩ��ˮ������ȡA����ϩ���Ľṹ��ʽΪ_______��
��3��A�����ᡢŨ���Ṳ�ȷ�Ӧ�����ѵĻ�ѧ��Ϊ_______������ţ���ͬ�����÷�Ӧ���л������й����ŵ�����Ϊ_______��
��4����Cu���ͼ��������£�A��O2��Ӧ���Ѣ١����������ۼ���д���÷�Ӧ�Ļ�ѧ����ʽ_______��
��5��A������̪�ȣ�SOCl2����һ�������·�Ӧ����һ��һ�ȴ�����A ���ѵĹ��ۼ�Ϊ_______���÷�Ӧ����Ϊ_______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com