
 CH3OH(g) ��H1=��116 kJ��mol��1
CH3OH(g) ��H1=��116 kJ��mol��1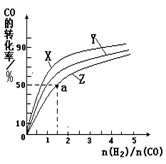

 O2(g)=CO2(g) ��H2=��283 kJ��mol��1
O2(g)=CO2(g) ��H2=��283 kJ��mol��1 O2(g)=H2O(g) ��H3=��242 kJ��mol��1
O2(g)=H2O(g) ��H3=��242 kJ��mol��1 CH3OH(g)
CH3OH(g) =
= =4L2?mol��2
=4L2?mol��2
 CO2(g)+2H2O(g) ��H=��651kJ?mol��1
CO2(g)+2H2O(g) ��H=��651kJ?mol��1 CH3OH(g)������Ӧ���������ʵ�����С�ķ������ŷ�Ӧ��������У������������ܵ����ʵ�����С����˺��¡����������£������ڵ�ѹǿ��С����ѹǿ���ٱ仯��˵�������������ܵ����ʵ������ֲ��䣬��Ӧ�ﵽƽ�⣬��a��ȷ���������������ʺ�CO���������ʶ�������Ӧ���ʣ�����֮��ʼ�յ���ϵ��֮�ȣ�ȱ���淴Ӧ���ʣ���b����CO(g)+2H2(g)
CH3OH(g)������Ӧ���������ʵ�����С�ķ������ŷ�Ӧ��������У������������ܵ����ʵ�����С����˺��¡����������£������ڵ�ѹǿ��С����ѹǿ���ٱ仯��˵�������������ܵ����ʵ������ֲ��䣬��Ӧ�ﵽƽ�⣬��a��ȷ���������������ʺ�CO���������ʶ�������Ӧ���ʣ�����֮��ʼ�յ���ϵ��֮�ȣ�ȱ���淴Ӧ���ʣ���b����CO(g)+2H2(g) CH3OH(g)����H1=��116 kJ��mol��1��˵������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������Ȼ��淴Ӧ�����ƶ�����CO��ת���ʼ�С����c������������ʹƽ���ƶ������Լӿ췴Ӧ���ʣ����ʹ�ô��������̴ﵽƽ���ʱ�䣬���Dz������CH3OH�IJ�������d������2���ٺϳɼ״������Ƿ��ȷ�Ӧ�������¶�ƽ�������Ȼ��淴Ӧ�����ƶ���CO��ƽ��ת���ʼ�С����CO��ת����ԽС����Ӧ�¶�Խ�ߣ�ͼ��n(H2)/n(CO)���ֲ���ʱ��CO��ƽ��ת���ʣ�X>Y>Z��������Z��Ӧ���¶���270�棻�ڶ�ͼ�ɵã�a��ĺ�����n(H2)/n(CO)=1.5��������CO��ƽ��ת����Ϊ50%������ʼʱn(CO)=1mol����n(H2)=1.5mol����
CH3OH(g)����H1=��116 kJ��mol��1��˵������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������Ȼ��淴Ӧ�����ƶ�����CO��ת���ʼ�С����c������������ʹƽ���ƶ������Լӿ췴Ӧ���ʣ����ʹ�ô��������̴ﵽƽ���ʱ�䣬���Dz������CH3OH�IJ�������d������2���ٺϳɼ״������Ƿ��ȷ�Ӧ�������¶�ƽ�������Ȼ��淴Ӧ�����ƶ���CO��ƽ��ת���ʼ�С����CO��ת����ԽС����Ӧ�¶�Խ�ߣ�ͼ��n(H2)/n(CO)���ֲ���ʱ��CO��ƽ��ת���ʣ�X>Y>Z��������Z��Ӧ���¶���270�棻�ڶ�ͼ�ɵã�a��ĺ�����n(H2)/n(CO)=1.5��������CO��ƽ��ת����Ϊ50%������ʼʱn(CO)=1mol����n(H2)=1.5mol���� CH3OH(g)
CH3OH(g) =
= =4L2?mol��2
=4L2?mol��2 CH3OH(g)������Ӧ�����������С�ķ����������������С��ϵѹǿʱ��ƽ�����������������淴Ӧ�����ƶ������淴Ӧ���ʴ�������Ӧ���ʣ�b�����ڷ�Ӧ��������������������������С��������Ӧ���ʺ��淴Ӧ���ʾ����Լ�С��c���ﵽ��ƽ��֮ǰ���淴Ӧ������С������Ӧ������������Ϊƽ�����淴Ӧ�����ƶ���������Ũ����С����Ӧ��Ũ������������ԭƽ���С��d���ﵽ��ƽ��ʱ������Ӧ���ʺ��淴Ӧ������ȣ�������ԭƽ���С����3���Ƚ���֪�����Ȼ�ѧ����ʽ���Ϊ�٢ڢۣ��ٸ��ݸ�˹���ɣ��ɢ�+�ۡ�2���ٿɵã�CH3OH(g)+3/2O2(g)
CH3OH(g)������Ӧ�����������С�ķ����������������С��ϵѹǿʱ��ƽ�����������������淴Ӧ�����ƶ������淴Ӧ���ʴ�������Ӧ���ʣ�b�����ڷ�Ӧ��������������������������С��������Ӧ���ʺ��淴Ӧ���ʾ����Լ�С��c���ﵽ��ƽ��֮ǰ���淴Ӧ������С������Ӧ������������Ϊƽ�����淴Ӧ�����ƶ���������Ũ����С����Ӧ��Ũ������������ԭƽ���С��d���ﵽ��ƽ��ʱ������Ӧ���ʺ��淴Ӧ������ȣ�������ԭƽ���С����3���Ƚ���֪�����Ȼ�ѧ����ʽ���Ϊ�٢ڢۣ��ٸ��ݸ�˹���ɣ��ɢ�+�ۡ�2���ٿɵã�CH3OH(g)+3/2O2(g)  CO2(g)+2H2O(g) ��H=��651kJ?mol��1��
CO2(g)+2H2O(g) ��H=��651kJ?mol��1��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ������ݻ�ѧ��Ӧ���й�ԭ��ͬ����������
������ݻ�ѧ��Ӧ���й�ԭ��ͬ����������



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 N2O4(g) ��H����52.7 kJ��mol��1
N2O4(g) ��H����52.7 kJ��mol��1 4NO(g)+6H2O(g) ��H<0
4NO(g)+6H2O(g) ��H<0| ƽ��ʱ���ʵ�����mol�� | n(NO) | n(H2O�� |
| �¶�T1 | 1.6 | 2.4 |
| �¶�T2 | 1.2 | 1.8 |
 =O2��+2H2O����������ӦΪ �����������������Ʒ�Ӧ2CO=2C+O2����H��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������ ��
=O2��+2H2O����������ӦΪ �����������������Ʒ�Ӧ2CO=2C+O2����H��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g)�Ļ����ϵ�У�SO3�İٷֺ������¶ȵĹ�ϵ����ͼ(�������κ�һ�㶼��ʾƽ��״̬����
2SO3(g)�Ļ����ϵ�У�SO3�İٷֺ������¶ȵĹ�ϵ����ͼ(�������κ�һ�㶼��ʾƽ��״̬����
 2SO3(g)�ġ�H 0���>����<���������ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫ �ƶ�������������ҡ���������
2SO3(g)�ġ�H 0���>����<���������ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫ �ƶ�������������ҡ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 CH3OH(g) ��H1
CH3OH(g) ��H1 CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2  CO(g)+3H2(g)��
CO(g)+3H2(g)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 2NH3(g) ��H����92.4 kJ��mol-1��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����
2NH3(g) ��H����92.4 kJ��mol-1��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����
 2NO(g) ��H����180.5 kJ��mol-1
2NO(g) ��H����180.5 kJ��mol-1 2H2O(g) ��H����483.6 kJ��mol-1
2H2O(g) ��H����483.6 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2������Ӻ�1�������ӷ�Ӧ����2��ˮ���ӣ��ų�����571.6 kJ |
| B��2 mol H2(g)��1 mol O2(g)��Ӧ����2 mol H2O(l)����������571.6 kJ |
| C��2 mol H2O(l)�ֽ�Ϊ2 mol H2(g)��1 mol O2(g)����������571.6 kJ |
| D��2 mol H2(g)��1 mol O2(g)��Ӧ����2 mol H2O(g)���ų�����571.6 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2��ȼ����Ϊ241.8kJ/mol |
| B��H2(g)+1/2O2(g)=H2O(l)����H<-241.8kJ/mol |
| C��2H2(g)+O2(g)=2H2O(g)����H>-241.8kJ/mol |
| D��1molH2��1/2molO2����������1molH2O(g)�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com