
| A. | 分子内共价键越强,分子越稳定,其熔沸点也越高 | |
| B. | C、H、O、N四种元素组成的化合物一定是离子化合物 | |
| C. | HF分子间存在着氢键,所以HF比HCl稳定 | |
| D. | 由原子构成的晶体可能是原子晶体,也可能是分子晶体 |
分析 A.稳定性与共价键有关,熔沸点与相对分子质量有关;
B、由C、H、O、N四种元素组成的化合物,可能为氨基酸,也可能为铵盐;
C、分子的稳定性和化学键有关和氢键无关;
D、稀有气体都是由原子构成的分子晶体,金刚石是由原子构成的原子晶体.
解答 解:A.稳定性与共价键有关,熔沸点与相对分子质量有关,则分子内共价键越强,分子越稳定,但熔沸点不能确定,故A错误;
B、由C、H、O、N四种元素组成的化合物,可能为氨基酸,只存在共价键,为共价化合物,故B错误;
C、分子的稳定性和化学键有关和氢键无关,故C错误;
D、稀有气体都是由原子构成的分子晶体,金刚石是由原子构成的原子晶体,故D正确;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断、常见物质中的化学键为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 根据碳酸盐与盐酸反应能放出二氧化碳气体,确定某矿石中是否含碳酸盐 | |
| B. | 根据纤维在火焰上燃烧产生的气味,确定该纤维是否为蛋白质纤维 | |
| C. | 根据加入氯化钡溶液的方法来检验溶液中是否含有硫酸根离子 | |
| D. | 根据氨气能使湿润的红色石蕊试纸变蓝色,可以用于铵根离子的检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 [Al(OH)2]++H+.
[Al(OH)2]++H+.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
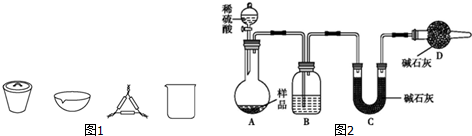
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 间二甲苯的二氯代物有5种 | |
| B. | 二氯甲烷有2种同分异构体 | |
| C. | 丙烯分子中所有的原子有可能在同一平面上 | |
| D. | 用-C4H9取代苯环上的1个氢原子,最多可得4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
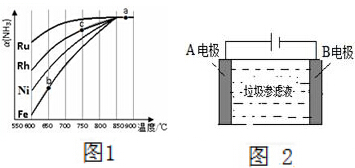 氨气在生产、生活和科研中应用十分广泛.
氨气在生产、生活和科研中应用十分广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ⑤②①④③ | C. | ②⑤④①③ | D. | ④①②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉胶体加入电解质可发生聚沉现象 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体与溶液 | |
| D. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com