
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
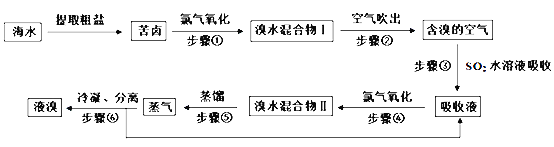
(1)步骤①获得Br2的离子反应方程式为:_________________________。
(2)步骤③所发生反应的化学方程式为:_________________________。在该反应中,氧化剂是______________(填化学式);若反应中生成2molHBr,则转移电子数约为_____________个。
(3)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是:_______________。
(4)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(5)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ,请说明原因:________________。
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) △H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

A. 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ表示的是t1时刻通入氦气增大体系压强对反应速率的影响
C. 图Ⅱ表示的t1时刻加入催化剂后对反应速率的影响
D. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图海水综合利用的工业流程图,判断下列说法正确的是
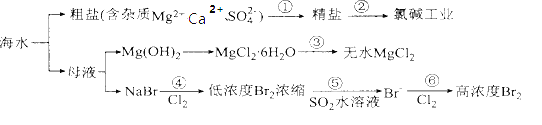
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等.
A.过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤后加盐酸
B.过程②通过氧化还原反应可产生1种单质
C.在过程③中将MgCl26H2O直接灼烧得到MgCl2
D.在过程④、⑥反应中每氧化0.2molBr-需消耗标准状况下2.24LCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2X溶液中滴加0.2mol/L NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法不正确的是
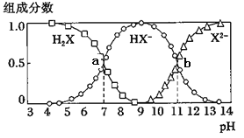
A. 水的电离程度: b点大于点a
B. 将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C. 常温下HY的K=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y—=HY+HX—
D. 常温下,反应X2— + H2O ![]() HX— + OH—的平衡常数对数值1gK= -3
HX— + OH—的平衡常数对数值1gK= -3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+2D(g)的下列反应速率,其中反应速率最大的是
2C(g)+2D(g)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 molL-1s-1 B. υ(C)=0.5 molL-1min-1
C. υ(B)=0.6 molL-1min-1 D. υ(A)=0.2molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
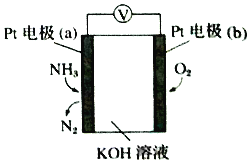
A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 正极的电极反应式为O2+4e-+4H+=2H2O
D. 负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写错误的是
A. MgCl2=Mg2++2Cl B. NaOH=Na++O2+H+
C. HCl=H+ +Cl D. K2SO4=2K++SO42
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com