
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 坩埚质量(g) | 坩埚和晶体的总质量(g) | 加热后坩埚和剩余固体的质量(g) |
| 11.685 | 13.691 | 12.948 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
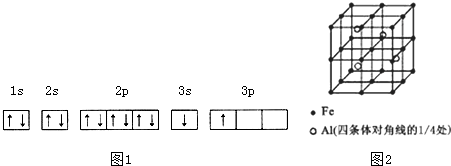
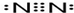 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
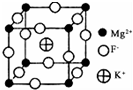 卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途.
卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
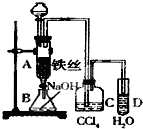 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
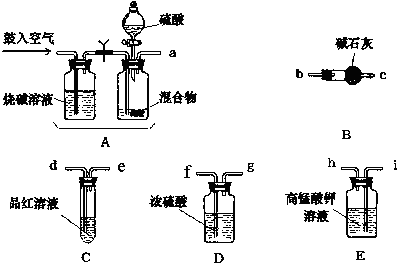
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应不一定全部是氧化还原反应 | |
| B. | 氧化还原反应中氧化剂和还原剂可以是同种物质 | |
| C. | 氧化反应和还原反应不一定同时发生 | |
| D. | 还原剂是得电子,氧化剂失电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com