
����Ŀ��ijʵ��С��ͬѧ��������ʵ�飬�Լ��黯ѧ��Ӧ�е������仯��
��ش��������⣺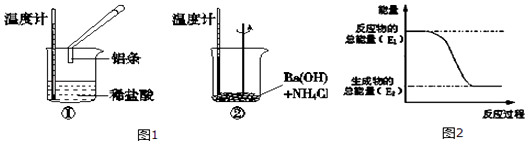
��1��ʵ���з��֣���Ӧ����е��¶����ߣ����е��¶Ƚ��ͣ��ɴ��ж�����������ķ�Ӧ���ȷ�Ӧ��Ba��OH��28H2O��NH4Cl�ķ�Ӧ�� �ȷ�Ӧ����Ӧ����
����١��ڡ����������仯����ͼ2��ʾ��
��2��һ�����������������г��ȼ�ղ��ų���������������̬ˮ�ų�������ΪQ1������Һ̬ˮ�ų�������ΪQ2 �� ��ôQ1Q2������ڡ�����С�ڡ����ڡ�����
��3����֪��4HCl+O2�T2Cl2+2H2O���÷�Ӧ�У�4mol HCl���������ų�115.6kJ����������Ͽ�1mol H��O����Ͽ�1mol H��Cl�������������ԼΪkJ��![]()
���𰸡�
��1����,��,��
��2����
��3��31.9
���������⣺��1��Al��HCl��Ӧ���¶����ߣ���˵����Ӧ���ȣ�Ba��OH��28H2O��NH4Cl�ķ�Ӧ�¶Ƚ��ͣ�˵����ӦΪ���ȷ�Ӧ����Ӧ��Ϊ���ȷ�Ӧ����Ӧ�������������������������������Ԣٵ������仯����ͼ2��ʾ��
���Դ��ǣ��ţ������٣�
��2������һ��������������ͬ�����¶����ȼ�գ���ȼ�պ�����ˮ��������������̬ˮ����Q1=Q2������ʵ������ȼ�շֱ�����Һ̬ˮ����̬ˮ������̬ˮת��ΪҺ̬ˮ��Ҫ�ų���������Q1��Q2��
���Դ��ǣ�С�ڣ�
��3��E��H��O����E��HCl���ֱ��ʾH��O���ܡ�H��Cl���ܣ���ӦA�У�4mol HCl���������ų�115.6kJ����������Ӧ�ȡ�H=��Ӧ���ܼ��ܩ���������ܼ��ܣ��ʣ�4��E��H��Cl��+498kJ/mol��[2��243kJ/mol+4��E��H��O��]=��115.6kJ/mol�������ã�4E��H��Cl����4E��H��O��=��127.6kJ/mol����E��H��O����E��HCl��=31.9kJ/mol���ʶϿ�1mol H��O����Ͽ�1mol H��Cl�������������ԼΪ31.9kJ/mol��1mol=31.9kJ��
���Դ��ǣ�31.9��
�����㾫�������÷�Ӧ�Ⱥ��ʱ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹ����˵����ȷ���� ()
A. ��������ɶ��������ˮͨ�����Ϸ�Ӧֱ���Ƶ�
B. ����ǿ���������ԭ������������ȡ����
C. ��Ϊ����������ˮ������������������������Һ��Ӧ
D. �����ȶ��Խ�ǿ�����Ȳ��ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������нṹ��ԭ��һ�����ڼ��������
A. �������ֻ��һ������B. ����������Ϊ������������һ��
C. M�������ΪK���������1/2D. K��L�������֮�ͱ�M���������5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʿ���������������Һ���Ҵ�����
A. ϡ���� B. ˮ C. �Ȼ�����Һ D. ̼������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��ﲻ��ͨ���ӳɷ�Ӧ��ȡ����
A. CH3CH2ClB. CH2ClCH2ClC. CH3COOHD. CH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�������ͺ��Ȼ�����Һ ��39�����Ҵ���Һ ���Ȼ��ƺ͵������ˮ��Һ���������ϸ����Һ����ȷ���������ǣ� ��
A. ��Һ����ȡ������ B. ��ȡ������Һ
C. ��Һ��������ȡ D. ������ȡ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȼ����Ϊ��H=��a kJ/mol�������·�Ӧ��
��C3H8��g��=C3H6��g��+H2��g����H=+b kJ/mol
��2C3H6��g��+9O2��g��=6CO2��g��+6H2O��l����H=��c kJ/mol
��2H2��g��+O2��g��=2H2O��l����H=��d kJ/mol ��b��c��d��Ϊ��ֵ������ȷ�ģ�������
A.2a=c��d��2b
B.-a=c��d��2b
C.2a=c+d��2b
D.a=c+d��b/2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ƿ�����ȵ����壬��ͬ��ͬѹʱƿ�����壨N2O��CO2��������ѧ��Ӧ���Ĺ�ϵ��һ����ȷ���ǣ�������
A.������ԭ�������
B.��������������
C.�������������������
D.������ܶ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���6.72L NH3��1.204��1023�� H2S ��5.6g CH4��0.5mol HCl�����й�ϵ��ȷ���ǣ�������
A.�����С���ܣ��ۣ��٣���
B.ԭ����Ŀ���ۣ��٣��ܣ���
C.�ܶȴ�С���ܣ��ڣ��ۣ���
D.������С���ܣ��ۣ��ڣ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com