
下列反应可能会生成Na2O2的是( )
A. 金属钠高温还原CO2,制人工金刚石膜或粉
B. 汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠
C. 隔绝空气条件下加热金属钠与NaNO2反应制取Na2O
D. 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热
考点: 钠的重要化合物.
分析: A.二氧化碳与过氧化钠反应;
B.氧化铁的氧化性小于过氧化钠;
C.过氧化钠具有强氧化性,可氧化NaNO2;
D.在加热过程中,钠可与空气中氧气反应生成过氧化钠.
解答: 解:A.金属钠高温还原CO2,因二氧化碳与过氧化钠反应,则不可能合成过氧化钠,故A错误;
B.因氧化铁的氧化性小于过氧化钠,氧化铁与钠反应只能生成氧化钠,故B错误;
C.过氧化钠具有强氧化性,可氧化NaNO2,则钠与NaNO2反应不可能生成Na2O2,故C错误;
D.在加热过程中,钠可与空气中氧气反应生成过氧化钠,故D正确.
故选D.
点评: 本题综合考查过氧化钠知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,答题时考虑把握氧化性的强弱比较,难度不大.


科目:高中化学 来源: 题型:
同分异构体具有( )
①相同的相对分子质量 ②相同的分子式 ③相同的结构式 ④相同的物理性质 ⑤相同的化学性质.
A. ①② B. ②③⑤ C. ①②⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
酯类物质广泛存在于香蕉、梨等水果中.某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到了乙酸和另一种化学式为C6H13OH的物质.对于此过程,以下分析中不正确的是( )
|
| A. | C6H13OH分子含有羟基 |
|
| B. | C6H13OH可与金属钠发生反应 |
|
| C. | 实验小组分离出的酯可表示为CH3COOC6H13 |
|
| D. | 不需要催化剂,这种酯在水中加热即可大量水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置进行下列实验,能达到实验目的是( )
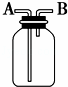
A. 瓶中盛有适量浓H2SO4,从A口进气来干燥NH3
B. 从B口进气,用排空气法收集CO2
C. 瓶中盛满水,从B口进气,用排水法收集NO2
D. 瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
A. 反应中硫元素被氧化,所有铁元素均被还原
B. 氧化剂是Fe3+,氧化产物是Cu2+
C. 反应中转移电子的物质的量为xmol
D. 反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y﹣x)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到氢气bmol,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为( )
A.  mol B. (a﹣b)mol C.
mol B. (a﹣b)mol C.  mol D. (a+b)mol
mol D. (a+b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某品牌奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌.NaNO2有像食盐一样的咸味,能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O.
(1)上述反应中若有1.75mol的还原剂被氧化,则被还原的氧化剂是 mol.
(2)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂 能使NaNO2转化为不引起二次污染的N2.(填编号)①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
反应的化学方程式为 .若此废水呈强碱性,需调节溶液的pH接近中性,再添加氯化铵溶液,否则会引起二次污染,反应的方程 .
(3)向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式与事实不相符的是
A.OH﹣+CO32﹣+2H+→HCO3﹣+H2O B.2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
C.2OH﹣+CO32﹣+4H+→CO2↑+3H2O D.OH﹣+CO32﹣+3H+→CO2↑+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
甲乙两人分别用不同的方法配制100ml 3.6mol/L的稀硫酸.
(1)甲:量取20ml 18mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100ml 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀.
①实验所用的玻璃仪器除烧杯和容量瓶外,还有 ;
②将溶液转移到容量瓶中的正确操作是 ;
③定容的正确操作是 .
(2)乙:用100ml 量筒量取20ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100ml 刻度线,再搅拌均匀.
你认为此法是否正确?若不正确,指出其中错误之处 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(N0表示阿伏加德罗常数的值)( )
①在常温常压下,11.2L N2含有的分子数为0.5N0
②在常温常压下,1mol Ne含有的原子数为N0
③71g Cl2所含原子数为2N0
④在同温同压时,相同体积的任何气体单质所含的原子数相同.
|
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com