
| A. | FeCl3 | B. | Fe(OH)3 | C. | FeO | D. | Fe2O3 |
分析 根据三氯化铁在溶液中存在水解平衡,从平衡移动的角度分析,Fe3+发生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,得到水解产物氢氧化铁,灼烧得到氧化铁.
解答 解:在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热发生2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,使Fe(OH)3分解生成Fe2O3,
故选D.
点评 本题考查盐类的水解,题目难度不大,注意水解平衡移动的影响因素.


科目:高中化学 来源: 题型:选择题
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 黑火药的使用 | D. | 打磨磁石制指南针 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/(×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不可能生成90g 乙酸乙酯 | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成61.6g 乙酸乙酯 | D. | 生成的水分子中一定含有18O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
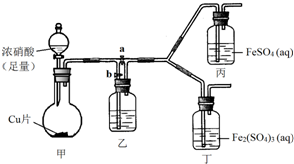 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO${\;}_{3}^{-}$+2H+=Fe3++NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com