
某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度。下列叙述正确的是( )
A.沉淀物的质量为5.6g B.沉淀物的质量为7.4g
C.饱和石灰水的质量大于98.2g D.饱和石灰水的质量小于98.2g
科目:高中化学 来源: 题型:
实验室为了使用方便,通常将氯气溶解于水中形成氯水或将其降温加压形成液氯来使用。下列有关这两种液体的实验描述都正确的是( )
A.两种液体都可以使干燥的布条褪色
B.两种液体都可以使干燥的蓝色石蕊试纸变红
C.用这两种液体都可给自来水消毒
D.分别向这两种液体中投入几颗金属锌粒均有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是
A.硅单质常用于制造太阳能电池和光纤 B.石灰石在工业上常用制造水泥和玻璃
C.碳酸氢钠在医疗上可用于治疗胃酸过多 D.氧化铝可用于制造耐高温的容器
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。
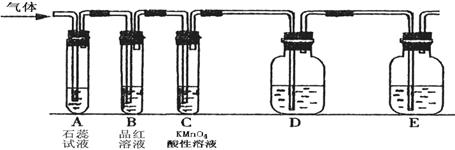 |
(1)从物质分类的角度,SO2属于 (填“酸性”或“碱性”)氧化物。写出硫酸型酸雨形成的反应方程式: 。
① 图中D装置可用来验证SO2具有该性质,其中所加入的试剂是 。
② 当向该装置通入SO2时,A中紫色石蕊溶液变红,用化学用语解释其原因是 。(2)从元素化合价的角度分析,SO2的性质。
①当向该装置通入SO2 一段时间后,可观察C中溶液褪色,MnO4-转化为Mn2+,说明SO2具有 性,反应的离子方程式为 。
②如验证SO2还具有另一方面的性质,可选择的药品是 。
A.过氧化氢 B. 浓硫酸 C.氯水 D.硫化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )。
A.称量时NaOH已经潮解
B.向容量瓶中转移溶液时,容量瓶事先用蒸馏水洗涤过
C.定容时俯视容量瓶的标线
D.摇匀后发现液面低于标线,滴加蒸馏水至标线再摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
一位同学欲配制6 mol·L-1的H2SO4溶液。他找来了三种不同浓度的硫酸:①240 mL 1 m ol·L-1的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1的浓硫酸。另外,他找来了三种规格的容量瓶:250 mL容量瓶;500 mL容量瓶;1 000 mL容量瓶。这位同学希望将①②两种硫酸全部用完,不足部分再由③补充。请通过计算,帮助这位同学确定选用哪种规格的容量瓶,以及需要浓硫酸的体积是多少。
ol·L-1的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1的浓硫酸。另外,他找来了三种规格的容量瓶:250 mL容量瓶;500 mL容量瓶;1 000 mL容量瓶。这位同学希望将①②两种硫酸全部用完,不足部分再由③补充。请通过计算,帮助这位同学确定选用哪种规格的容量瓶,以及需要浓硫酸的体积是多少。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是
A . c(SO42-)>c(HS-)>c(OH-)>c(H+)
B. c(Na+)>c(K+)>c(H+)>c(OH-)
C. c(Na+)=c(S2-)+c(H2S)+c(HS-)+c(SO42-)
D. c(Na+)+c(K+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某无色透明的溶液中所含的离子仅有Na+、CH3COO-、H+和OH-四种离子,试回答下列问题:
⑴该溶液所含的四种离子的物质的量浓度大小之间的关系是否只有一种可能(填“是”或“否”),其原因是: 。
⑵某学生将该溶液中的四种离子的物质的量浓度按从大到小的顺序排列了若干种可能,其中合理的是:
A. c(Na+)>c(CH3COO-)>c(OH-)>c(H+) B. c(CH3COO-)=c(Na+)>c(OH-)=c(H+)
C. c(H+)>c(OH-)>c(Na+)>c(CH3COO-) D. c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
62. ⑴室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)_ _0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) -c(M+) = mol·L-1;
c(H+) -c(MOH) = ____ mol·L-1
⑵室温下如果取0.2mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度______MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com