
分析 (1)①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
③CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,
由盖斯定律可知,①×2+②-③得到CO(g)+2H2(g)=CH3OH(l);
(2)SO2的起始浓度为2.00mol•L-1,O2的起始浓度为4.00mol•L-1,3min后SO3的浓度1.50mol•L-1,则
2SO2+O2?2SO3,
开始 2 4 0
转化 1.5 0.75 1.5
3min 0.5 3.25 1.5
结合v=$\frac{△c}{△t}$计算.
解答 解:(1)①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
③CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,
由盖斯定律可知,①×2+②-③得到CO(g)+2H2(g)=CH3OH(l),△H=(-285.8kJ/mol)×2+(-283.0kJ•mol-1)-(-726.5kJ•mol-1)=-128.1kJ/mol,由CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-128.1kJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-128.1kJ/mol;
(2)SO2的起始浓度为2.00mol•L-1,O2的起始浓度为4.00mol•L-1,3min后SO3的浓度1.50mol•L-1,则
2SO2+O2?2SO3,
开始 2 4 0
转化 1.5 0.75 1.5
3min 0.5 3.25 1.5
v(SO2)=$\frac{1.5mol/L}{3min}$=0.5mol/(L.min),v(O2)=$\frac{1.5mol/L}{3min}$×$\frac{1}{2}$=0.25mol/(L.min),v(SO3)=$\frac{1.5mol/L}{3min}$=0.5mol/(L.min),3min时C(SO2)=0.5mol/L,c(O2)=4mol/L-0.75mol/L=3.25mol/L,
故答案为:0.5mol/(L.min);0.25mol/(L.min);0.5mol/(L.min);0.5mol/L;3.25mol/L.
点评 本题考查化学平衡的计算,为高频考点,把握盖斯定律计算反应热、化学平衡三段法、反应速率计算等为解答的关键,侧重分析与计算能力的考查,注意盖斯定律的应用及三段法的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水或熔融氯化钠时,阳极的电极反应式均为2Cl--2e-═Cl2↑ | |
| B. | 钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-═Fe2+ | |
| C. | 精炼铜和电镀铜时,与电源负极相连的电极反应式均为Cu2++2e-═Cu | |
| D. | 酸性介质或碱性介质的氢氧燃料电池的正极反应式均为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
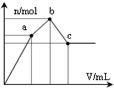 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点Al(OH)3开始溶解 | |
| B. | c点溶液呈中性 | |
| C. | b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ | |
| D. | ab段与bc段消耗的Ba(OH)2溶液的体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成H2的质量为0.01g | |
| B. | 生成的H2中含有的氢原子数为1.204×l023个 | |
| C. | 生成H2的体积为0.112L(以标准状况) | |
| D. | 生成H2的物质的量为0.01mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽马鞍山二中高一10月阶段测化学卷(解析版) 题型:填空题
在KCl和CaCl2的混合物中,K+和Ca2+的物质的量之比为2:1,则KCl和 CaCl2的质量之比为______,若要取出含1 mol Cl-的该混合物,应称取该混合物的质量为________g。
CaCl2的质量之比为______,若要取出含1 mol Cl-的该混合物,应称取该混合物的质量为________g。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽马鞍山二中高一10月阶段测化学卷(解析版) 题型:选择题
下列条件中,两种气体所含原子数一定相等的是
A.同质量、不同体积的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H6和NO D.同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上定时训练8化学卷(解析版) 题型:选择题
下列各组中的固体物质,只需加水就可以鉴别的一组是
A. CaCO3、BaSO4、Na2CO3 B. CuSO4、NaCl、NaCO3
C. NaCl、CuSO4、CaCO3 D. NaCl、KNO3、BaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com