
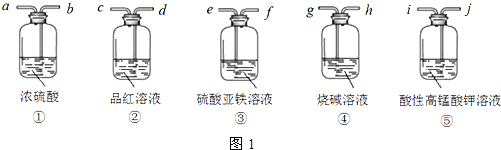
| A. | 6种 | B. | 5种 | C. | 8种 | D. | 7种 |
科目:高中化学 来源: 题型:选择题
| A. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| B. | Fe(OH)3胶体为无色、透明,能发生丁达尔现象 | |
| C. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| D. | SiO2既能和氢氟酸反应又能和氢氧化钠溶液反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 催化剂组成 | 1 | 2 | 3 |
| WO3 W α-Fe2O3 | 65% 5% 30% | 65% 10% 25% | a b 20% |
| 六价铬去除率 | 60.2% | 80% | 72.9% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
| 熔点/℃ | 122.4 | -114.1 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 212.6 |
| 密度/g•cm-3 | 1.2659 | 0.816 | 1.05 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
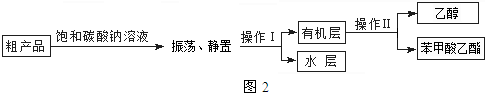
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银、氨水 | B. | 硫酸亚铁溶液、氢氧化钠溶液 | ||
| C. | 明矾溶液、氢氧化钡溶液 | D. | 氯化铝溶液、氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
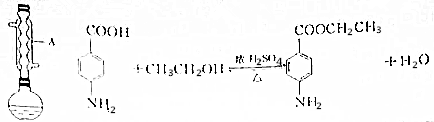
| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 340 | 微溶 |
| 苯佐卡因 | 165 | 1.039 | 90 | 172 | 难溶 |
| 乙醚 | 74 | 0.71 | -116.3 | 35 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
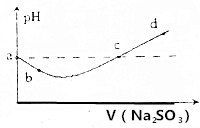
| A. | a点表示的溶液中存在3种分子,3种离子 | |
| B. | b点溶液中不存在SO2 | |
| C. | c点溶液中c(Na+)=2c(HSO3-)+2c(SO32-) | |
| D. | d点溶液中不存在HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | S | SCl2 | S2Cl2 |
| 沸点/℃ | 445 | 59 | 137 |
| 熔点/℃ | 113 | -122 | -77 |
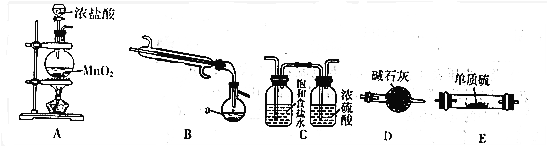
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com