
АыУГЎ°»ЇС§ХфЖшЧЄТЖ·ЁЎ±ЦЖ±ёTaS2ѕ§МеЈ¬ДіОВ¶ИПВµД2LєгИЭГЬ±ХИЭЖчЦРјУИлТ»¶ЁБї µД I2ЈЁgЈ©єНTaS2ЈЁsЈ©·ўЙъИзПВ·ґУ¦
TaS2ЈЁsЈ©+2I2ЈЁgЈ© TaI4ЈЁgЈ©+S2ЈЁgЈ©ЎчHЈЅa kJЎ¤mol-1 ЈЁIЈ©
TaI4ЈЁgЈ©+S2ЈЁgЈ©ЎчHЈЅa kJЎ¤mol-1 ЈЁIЈ©
ґпЖЅєвК±Ј¬TaS2ЈЁsЈ©ЎўI2ЈЁgЈ©ЎўTaI4ЈЁgЈ©ЎўЎўS2ЈЁgЈ©µДОпЦКµДБї·Ц±рОЄ3 mol Ўў2molЎў2molЎў2molЎЈ
ЈЁ1Ј©·ґУ¦ЈЁIЈ©µДЖЅєвіЈКэ±нґпКЅK=
ЈЁ2Ј©ИфёГОВ¶ИПВёГИЭЖчЦРДіК±їМTaS2ЈЁsЈ©ЎўI2ЈЁgЈ©ЎўTaI4ЈЁgЈ©ЎўЎўS2ЈЁgЈ©µДОпЦКµДБї·Ц±рОЄ2molЎў2molЎў4molЎў4molЈ¬ФтёГК±їМЖЅєвПт ЈЁМоЎ°Хэ·ґУ¦Ў±»тЎ°Дж·ґУ¦Ў±Ј©ТЖ¶ЇЈ¬vХэ vДжЈЁМоЎ°ЈѕЎ±ЎўЎ°ЈЅЎ±»тЎ°ЈјЎ±Ј©ЎЈ
ЈЁ3Ј©ФЪІ»Н¬ОВ¶ИПВЈ¬ёГ·ґУ¦µДЖЅєвіЈКэKИзПВ±нЈє
| ОВ¶И/Ўж | 40 | 80 | 200 |
| ЖЅєвіЈКэK | 1 | 1.5 | 4 |

ЅвОцКФМв·ЦОцЈєЖЅєвіЈКэКЗЦёїЙДж»ЇС§·ґУ¦ґпµЅЖЅєвК±Ј¬ГїёцІъОпЕЁ¶ИПµКэґОГЭµДБ¬іЛ»эУлГїёц·ґУ¦ОпЕЁ¶ИПµКэґОГЭµДБ¬іЛ»эЦ®±ИЈ¬ѕЭМвТвїЙЦЄ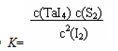 ·ґУ¦ЅшРРµГФЅНкИ«Ј¬ЖЅєвіЈКэѕНФЅґуЈ¬¶шµ±ёГОВ¶ИПВёГИЭЖчЦРДіК±їМTaS2ЈЁsЈ©ЎўI2ЈЁgЈ©ЎўTaI4ЈЁgЈ©ЎўЎўS2ЈЁgЈ©µДОпЦКµДБї·Ц±рОЄ2molЎў2molЎў4molЎў4molЈ¬ЛгіцµДЖЅєвіЈКэ±ИЈЁ1Ј©µДРЎЈ¬ТтґЛ·ґУ¦КЗПтДж·ґУ¦·ЅПтЅшРРµДЈ¬ґЛК±Дж·ґУ¦ЛЩВКґуУЪХэ·ґУ¦ЛЩВКЎЈЛж·ґУ¦ОВ¶ИФцґуЈ¬»ЇС§ЖЅєвіЈКэТІЦрЅҐФцґуЈ¬УЙґЛїЙЦЄёГ·ґУ¦КЗОьИИ·ґУ¦ЎЈ¶шЧЄ»ЇВКµИУЪТСЧЄ»ЇµДОпЦКµДБїіэТФФОпЦКµДБїФЩіЛТФ°Щ·ЦЦ®Т»°ЩЎЈ
·ґУ¦ЅшРРµГФЅНкИ«Ј¬ЖЅєвіЈКэѕНФЅґуЈ¬¶шµ±ёГОВ¶ИПВёГИЭЖчЦРДіК±їМTaS2ЈЁsЈ©ЎўI2ЈЁgЈ©ЎўTaI4ЈЁgЈ©ЎўЎўS2ЈЁgЈ©µДОпЦКµДБї·Ц±рОЄ2molЎў2molЎў4molЎў4molЈ¬ЛгіцµДЖЅєвіЈКэ±ИЈЁ1Ј©µДРЎЈ¬ТтґЛ·ґУ¦КЗПтДж·ґУ¦·ЅПтЅшРРµДЈ¬ґЛК±Дж·ґУ¦ЛЩВКґуУЪХэ·ґУ¦ЛЩВКЎЈЛж·ґУ¦ОВ¶ИФцґуЈ¬»ЇС§ЖЅєвіЈКэТІЦрЅҐФцґуЈ¬УЙґЛїЙЦЄёГ·ґУ¦КЗОьИИ·ґУ¦ЎЈ¶шЧЄ»ЇВКµИУЪТСЧЄ»ЇµДОпЦКµДБїіэТФФОпЦКµДБїФЩіЛТФ°Щ·ЦЦ®Т»°ЩЎЈ
їјµгЈєЦчТЄїјІй»ЇС§ЖЅєвµДПа№ШЦЄК¶µгЎЈ



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈєµҐСЎМв
ФЪИЭ»эОЄ1 LµДГЬ±ХИЭЖчЦРЈ¬јУИл5 mol AОпЦКЈ¬ФЪТ»¶ЁМхјюПВН¬К±·ўЙъПВБРБЅёц·ґУ¦ЈєўЩ2A(g)  2B(g)Ј«C(g)Ј»ўЪA(g)
2B(g)Ј«C(g)Ј»ўЪA(g)  C(g)Ј«D(g)Ј®µ±ґпµЅЖЅєвК±Ј¬ІвµГc(A)ЈЅ 2.5 mol/LЈ¬c(C)ЈЅ2.0 mol/L.ФтПВБРЛµ·ЁЦРХэИ·µДКЗ
C(g)Ј«D(g)Ј®µ±ґпµЅЖЅєвК±Ј¬ІвµГc(A)ЈЅ 2.5 mol/LЈ¬c(C)ЈЅ2.0 mol/L.ФтПВБРЛµ·ЁЦРХэИ·µДКЗ
AЈ®ґпµЅЖЅєвК±AµДЧЬЧЄ»ЇВКОЄ40%
BЈ®ґпµЅЖЅєвК±c(B)ОЄ1.0 mol/L
CЈ®ґпµЅЖЅєвК±c(B)ЈЅ2c(D)
DЈ®ґпµЅЖЅєвК±c(D)ЈЅ2c(B)
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈєµҐСЎМв
Т»¶ЁОВ¶ИПВЈ¬їЙДж·ґУ¦H2(g)+I2(g) 2HI(g)ґпµЅ»ЇС§ЖЅєвЧґМ¬µД±кЦѕКЗЈЁ Ј©
2HI(g)ґпµЅ»ЇС§ЖЅєвЧґМ¬µД±кЦѕКЗЈЁ Ј©
| AЈ®»мєПЖшМеµДС№ЗїІ»ФЩ±д»Ї | BЈ®»мєПЖшМеµДСХЙ«І»ФЩ±д»Ї |
| CЈ®·ґУ¦ЛЩВКv(H2)="0.5v" (HI) | DЈ®c (H2):c(I2):c(HI)=1:1:2 |
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈєµҐСЎМв
ДіОВ¶ИПВЈ¬ФЪТ»ИЭ»эїЙ±дµДИЭЖчЦРЈ¬·ґУ¦Јє2AЈЁgЈ©+BЈЁgЈ© 2CЈЁgЈ©ґпµЅЖЅєвК±Ј¬AЎўBєНCµДОпЦКµДБї·Ц±рОЄ4molЎў2 molєН4 molЎЈ±ЈіЦОВ¶ИєНС№ЗїІ»±дЈ¬¶ФЖЅєв»мєПОпЦРИэХЯµДОпЦКµДБїЧцИзПВµчХыЈ¬їЙК№ЖЅєвУТТЖµДКЗ ЈЁ Ј©
2CЈЁgЈ©ґпµЅЖЅєвК±Ј¬AЎўBєНCµДОпЦКµДБї·Ц±рОЄ4molЎў2 molєН4 molЎЈ±ЈіЦОВ¶ИєНС№ЗїІ»±дЈ¬¶ФЖЅєв»мєПОпЦРИэХЯµДОпЦКµДБїЧцИзПВµчХыЈ¬їЙК№ЖЅєвУТТЖµДКЗ ЈЁ Ј©
AЈ®ѕщјх°л BЈ®ѕщјУ±¶ CЈ®ѕщФцјУ1 mol DЈ®ѕщјхЙЩ1 mol
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈєµҐСЎМв
КµСйКТУГНУлПЎПхЛбЦЖИЎNOК±Ј¬ОЄјУїм·ґУ¦ЛЩВКїЙІЙИЎµДґлК©КЗ
| AЈ®ФцјУНµДУГБї | BЈ®ФцґуС№Зї |
| CЈ®ёфѕшїХЖшјУИИ | DЈ®ФцґуПхЛбµДЕЁ¶И |
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈєМоїХМв
ЈЁ10·ЦЈ©
ЈЁ1Ј©ЦЖ±ёЗвСх»ЇМъЅєМеµД»ЇС§·ЅіМКЅОЄ ЎЈ
ЈЁ2Ј©МјЛбЗвДЖФЪЛ®ИЬТєЦРµДµзАл·ЅіМКЅОЄ ЎЈ
ЈЁ3Ј©ДЬЦ¤ГчNa2SO3ИЬТєЦРґжФЪSO32Ј+H2O HSO3Ј+OHЈЛ®ЅвЖЅєвµДКВКµКЗ ЈЁМоСЎПоЧЦДёЈ©ЎЈ
HSO3Ј+OHЈЛ®ЅвЖЅєвµДКВКµКЗ ЈЁМоСЎПоЧЦДёЈ©ЎЈ
AЈ®µОИл·УМЄИЬТє±дємЈ¬ФЩјУИлH2SO4ИЬТєєуємЙ«НЛИҐ
BЈ®µОИл·УМЄИЬТє±дємЈ¬ФЩјУИлВИЛ®єуємЙ«НЛИҐ
CЈ®µОИл·УМЄИЬТє±дємЈ¬ФЩјУИлBaCl2ИЬТєєуІъЙъіБµнЗТємЙ«НКИҐ
ЈЁ4Ј©ПЦУРїЙДж·ґУ¦Јє2A(g)Ј«2B(g) C(g)Ј«3D(s)Ј¬ФЪГЬ±ХИЭЖчµДИЭ»эЎўОВ¶И¶јПаН¬µДМхјюПВЈ¬·Ц±рґУТФПВБЅМхНѕѕ¶ЅЁБўЖЅєвЈєўс. AЎўBµДЖрКјОпЦКµДБїѕщОЄ2 molЈ¬ўт.CЎўDµДЖрКјОпЦКµДБї·Ц±рОЄ2 molєН6 molЎЈТФПВЛµ·ЁЦРХэИ·µДКЗ ЈЁМоСЎПоЧЦДёЈ©ЎЈ
C(g)Ј«3D(s)Ј¬ФЪГЬ±ХИЭЖчµДИЭ»эЎўОВ¶И¶јПаН¬µДМхјюПВЈ¬·Ц±рґУТФПВБЅМхНѕѕ¶ЅЁБўЖЅєвЈєўс. AЎўBµДЖрКјОпЦКµДБїѕщОЄ2 molЈ¬ўт.CЎўDµДЖрКјОпЦКµДБї·Ц±рОЄ2 molєН6 molЎЈТФПВЛµ·ЁЦРХэИ·µДКЗ ЈЁМоСЎПоЧЦДёЈ©ЎЈ
AЈ®ўсЎўўтБЅМхНѕѕ¶ЧоЦХґпµЅЖЅєвК±Ј¬МеПµДЪ»мєПЖшМеµД°Щ·ЦЧйіЙПаН¬
BЈ®ґпµЅЖЅєвК±Ј¬Нѕѕ¶ўтЛщµГ»мєПЖшГЬ¶ИОЄНѕѕ¶ўсЛщµГ»мєПЖшГЬ¶ИµД2±¶
CЈ®ґпµЅЖЅєвК±Ј¬Нѕѕ¶ўтCµДЖЅєвЕЁ¶ИґуУЪНѕѕ¶ўсCµДЖЅєвЕЁ¶ИµД2±¶
ЈЁ5Ј©ФЪєгИЭѕшИИЈЁІ»УлНвЅзЅ»»»ДЬБїЈ©МхјюПВЅшРР2A (g)+ B(g) 2C(g)+ D(s)·ґУ¦Ј¬°ґПВ±нКэѕЭН¶БПЈ¬·ґУ¦ґпµЅЖЅєвЧґМ¬Ј¬ІвµГМеПµС№ЗїЙэёЯЎЈјтКцёГ·ґУ¦µДЖЅєвіЈКэУлОВ¶ИµД±д»Ї№ШПµЈє ЎЈ
2C(g)+ D(s)·ґУ¦Ј¬°ґПВ±нКэѕЭН¶БПЈ¬·ґУ¦ґпµЅЖЅєвЧґМ¬Ј¬ІвµГМеПµС№ЗїЙэёЯЎЈјтКцёГ·ґУ¦µДЖЅєвіЈКэУлОВ¶ИµД±д»Ї№ШПµЈє ЎЈ
| ОпЦК | A | B | C | D |
| ЖрКјН¶БП/mol | 2 | 1 | 2 | 0 |
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈєМоїХМв
(7·Ц)COїЙУГУЪєПіЙјЧґјЈ¬Т»¶ЁОВ¶ИПВЈ¬ПтМе»эОЄ2LµДГЬ±ХИЭЖчЦРјУИлCOєНH2Ј¬·ўЙъ·ґУ¦COЈЁgЈ©+2H2ЈЁgЈ© CH3OHЈЁgЈ©Ј¬ґпЖЅєвєуІвµГёчЧй·ЦЕЁ¶ИИзПВЈє
CH3OHЈЁgЈ©Ј¬ґпЖЅєвєуІвµГёчЧй·ЦЕЁ¶ИИзПВЈє
| ОпЦК | CO | H2 | CH3OH |
| ЕЁ¶И(mol?LЈ1) | 0.9 | 1.0 | 0.6 |
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈєМоїХМв
ЈЁ8·ЦЈ©Л®ГєЖшІ»ЅцКЗєПіЙ°±µДФБПЖшТІКЗєПіЙМюј°Жд»Ї№¤ІъЖ·µДФБПЎЈ
ЈЁ1Ј©Ц±ЅУЛ®ГєЖшИјБПµзіШЦРЈ¬НЁCOЎўH2µДј«ОЄµзіШµД ј«ЈЁСЎМоЈєЎ°ХэЎ±Ј¬Ў°ёєЎ±Ј©ЎЈ
ЈЁ2Ј©Л®ГєЖш±д»»·ґУ¦ЈєCO(g) + H2O(g)  CO2(g) + H2(g) ЎчH Јј 0Ј¬ПВБРґлК©ДЬМбёЯ·ґУ¦ЛЩВКµДУР ЈЁІ»¶ЁПоСЎФсЈ©ЎЈ
CO2(g) + H2(g) ЎчH Јј 0Ј¬ПВБРґлК©ДЬМбёЯ·ґУ¦ЛЩВКµДУР ЈЁІ»¶ЁПоСЎФсЈ©ЎЈ
a.ЙэёЯОВ¶И b.јУИлґЯ»ЇјБ c.ФцґуС№Зї d.ЅµµНЕЁ¶И
ЈЁ3Ј©H2єНN2ФЪґЯ»ЇјБЎўёЯОВёЯС№МхјюПВєПіЙ°±µД»ЇС§·ЅіМКЅОЄ ЎЈ
ЈЁ4Ј©°±ЖшµДЛ®ИЬТєїЙУГУЪОьКХСМµАЖшЦРµД¶юСх»ЇБтЈ¬ёГ·ґУ¦µД»ЇС§·ЅіМКЅОЄ ЎЈ
ЈЁ5Ј©Ѕ«±кЧјЧґїцПВ582.4LєПіЙЖшЈЁТСЦЄЈєn(CO)ЎГn(H2)=4ЎГ9Ј©НЁИлєПіЙЛюЈ¬Т»¶ЁМхјюПВїЙ·ўЙъ2CO(g)+ 4H2(g) Ўъ CH2=CH2(g)+2H2O(g)Ј»CO(g)+3H2ЎъCH4(g)+H2O(g)Ј¬ід·Ц·ґУ¦єуЈ¬ѕІв¶ЁІъЖ·ЦРЦ»УРјЧНйЎўТТП©єНЛ®ХфЖшЈЁјЩ¶ЁCOєНH2ѕщОЮКЈУаЈ©Ј¬КФјЖЛгТЭіцµДЖшМеЦРТТП©µДОпЦКµДБїЈЁБРіцјЖЛг№эіМЈ©ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈєМоїХМв
ЈЁ9·ЦЈ©Пх»щ±ЅјЧЛбТТхҐФЪOH-ґжФЪПВ·ўЙъЛ®Ѕв·ґУ¦ЈєO2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH.БЅЦЦ·ґУ¦ОпµДіхКјЕЁ¶ИѕщОЄ0.050mol/L,15 ЎжК±ІвµГЈєO2NC6H4COOC2H5µДЧЄ»ЇВК¦БЛжК±јд±д»ЇµДКэѕЭИз±нЛщКѕЎЈ»ШґрПВБРОКМвЈє
O2NC6H4COO-+C2H5OH.БЅЦЦ·ґУ¦ОпµДіхКјЕЁ¶ИѕщОЄ0.050mol/L,15 ЎжК±ІвµГЈєO2NC6H4COOC2H5µДЧЄ»ЇВК¦БЛжК±јд±д»ЇµДКэѕЭИз±нЛщКѕЎЈ»ШґрПВБРОКМвЈє
| t/s | 0 | 120 | 180 | 240 | 330 | 30 | 600 | 700 | 800 |
| ¦Б/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
Ійїґґр°ёєНЅвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com