
| A、通入少量SO2,溶液的漂白性增强 | ||
| B、加入少量Na2CO3粉末或CaCO3粉末,c(H+)减小,HClO浓度增大 | ||
| C、加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-) | ||
D、再加入少量水,
|
 HCl+HClO、H2O
HCl+HClO、H2O H++OH-、HClO
H++OH-、HClO H++ClO-.
H++ClO-.| c(H +) |
| c(ClO -) |
| c(H +) |
| c(ClO -) |


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
| 阳离子 | NH4+、Mg2+、Ba2+ |
| 阴离子 | OH-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| X | 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素第一电离能比其同周期的后一种元素高 |
| Y | 在地壳中的含量居于第三位,单质通常由电解法制取 |
| Z | 原子核外有五种不同能量的电子,且最外层有2个未成对电子 |
| T | 其合金在生产和生活中用量最大,原子核外有4个电子层,在化学反应中可以失去最外层的2个电子和次外层的1个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥⑧⑩ | B、②③④⑤⑨⑩ |
| C、③⑤⑦⑩ | D、①③⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
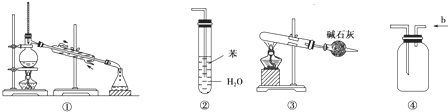
| A、装置①是用于分离互不相溶的液体混合物 |
| B、装置②可用于吸收NH3并防止倒吸 |
| C、以NH4HCO3为原料,装置③可用于实验室制备少量NH3 |
| D、装置④中b进气可收集Cl2、NO等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
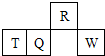 短周期主族元素R、T、Q、W在元素周期表中的相对位置如图所示,T元素的最高正价与最低负价的代数和为0.下列判断正确的是( )
短周期主族元素R、T、Q、W在元素周期表中的相对位置如图所示,T元素的最高正价与最低负价的代数和为0.下列判断正确的是( )| A、原子半径的大小:W>Q>R |
| B、气态氢化物的稳定性:R>Q>T |
| C、对应含氧酸的酸性强弱:W>Q>T |
| D、R分别与T、Q、W形成化合物的晶体均为分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com