
【题目】KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
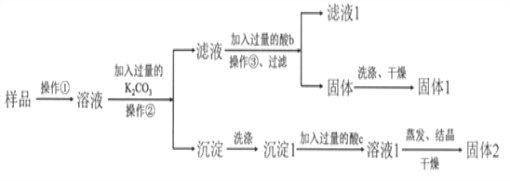
(1)试剂c的化学式是__________,固体1的化学式是__________。加入过量K2CO3所发生反应的化学方程式为________________________________。
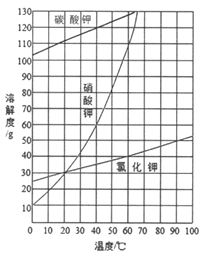
(2)结合下图各物质的溶解度曲线可知操作③的名称是_______、________。
(3)有同学认为操作③之前无需加入过量的酸b,也能得到纯净的固体1,你认为该同学的观点是否正确?_____;并做出相应解释___________________________。
【答案】HCl KNO3 BaCl2+K2CO3=BaCO3↓+2KCl 蒸发浓缩 冷却结晶 正确 由于硝酸钾的溶解度随温度降低急剧下降,因此有大量硝酸钾晶体析出,而碳酸钾溶解度很大,因而不会结晶析出
【解析】
样品溶解后加入过量K2CO3溶液,生成碳酸钡沉淀和氯化钾,过滤得到碳酸钡沉淀经过洗涤、再加过量的盐酸(c)发生反应得到氯化钡溶液,经蒸发、结晶、干燥可得到氯化钡固体;由于K2CO3过量,所以滤液中的物质有KNO3、KCl和K2CO3,因此要得到纯净的KNO3就需要除去K2CO3,所以加入过量的酸b为稀硝酸最合适,K2CO3和稀硝酸反应生成KNO3、水和二氧化碳,则所得溶液主要为KNO3和KCl,利用溶解度随温度变化不同,操作③可以采用蒸发浓缩、冷却结晶,析出KNO3晶体,过滤、洗涤、干燥得到固体1为KNO3;据此解答。
(1)本实验是为了提纯KNO3并分离得到BaCl2,固体1是硝酸钾,固体2就是氯化钡,所以试剂c是稀盐酸。加入过量K2CO3所发生反应的化学方程式为BaCl2+K2CO3=BaCO3↓+2KCl。
(2)根据图像可知KNO3的溶解度随温度降低急剧下降,KCl的溶解度随温度变化较小,因此将KNO3和KCl分离需要蒸发浓缩、冷却结晶,即操作③是蒸发浓缩、冷却结晶。
(3)该同学的观点正确。由于硝酸钾的溶解度随温度降低急剧下降,因此冷却结晶有大量硝酸钾晶体析出,而碳酸钾溶解度很大,因而不会结晶析出,所以操作③之前无需加入过量的盐酸除碳酸钾。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法不正确的是
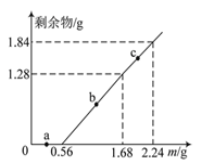
A. a点时溶液中阳离子为Cu2+、Fe2+和Fe3+
B. b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C. c点时溶液中溶质的物质的量浓度为0.5 mol·L-1
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若H2S的燃烧热化学方程式为H2S(g)+aO2(g)=X+cH2O(1)△H,则X应为( )
A. S(s) B. SO2(g) C. SO3(g) D. SO3(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按如图所示装置进行实验(部分夹持仪器及加热装置未画出)。
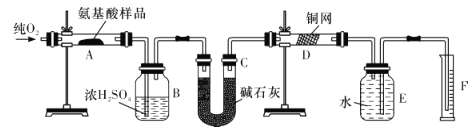
请回答下列有关问题:
(1)在安装E、F装置前,先要通入一段时间的氧气,其理由是_________。
(2)上述装置图中需要加热的仪器有________(填字母代号,下同),操作时应先点燃_____处的酒精灯。
(3)D装置的作用是_______________。
(4)A装置中发生反应的化学方程式是______________。
(5)读取N的体积时,应注意:①__________;②____________。
(6)实验中测得N2的体积为VmL(已折算成标准状况下)。为确定此氨基酸的分子式,还需要的有关数据有______(填字母代号)。
A.生成二氧化碳气体的质量 B.生成水的质量
C.通入氧气的体积 D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计制取SO2并验证其部分性质的实验装置图如下(夹持装置省略),下列叙述正确的是
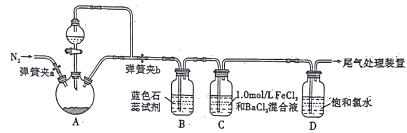
A. 关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,若能观察到C中长导管口有明显气泡现象,就能判断装置A、B部分气密性良好
B. A装置中比较理想的反应物质是Na2SO3固体和质量分数为10%的硫酸
C. B装置溶液变红色,说明SO2是酸性氧化物;C装置产生白色沉淀的原因为:BaCl2+SO2+H20![]() BaSO3↓+2HC1
BaSO3↓+2HC1
D. 取反应后D溶液少许,滴加品红溶液,红色褪去,不能说明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=—1966 kJmol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1 。
则5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= __________________________。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
① I2(s)+I-(aq)![]() I3-(aq) △H<0; ② I2 (s)+2I-(aq)
I3-(aq) △H<0; ② I2 (s)+2I-(aq)![]() I42-(aq)。
I42-(aq)。
温度降低时,反应①的平衡常数将______________(填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=__________________________。
(3)碘与钨在一定温度下,可发生如下可逆反应:W(s)+I2(g)![]() WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
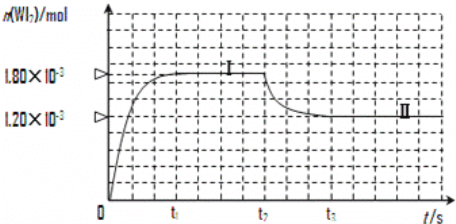
① 该反应△H____________0(填“>”或“<”)。
② 反应从开始到t1(t1= 3 min)时间内 I2 的平均反应速率v(I2)=_________。
③ 在450℃时,该反应的平衡常数K的值为__________________。
④ 能够说明上述反应已经达到平衡状态的有________________ (填选项字母)。
A.I2与WI2的浓度相等 B. 容器内各气体的浓度不再改变
C. 容器内混合气体的密度不再改变 D.容器内气体压强不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯的说法,正确的是( )
A.利用苯的硝化反应可以制得TNT炸药
B.苯可以使KMnO4酸性溶液褪色
C.苯分子含有碳碳双键,可以发生加成反应
D.苯分子的所有原子都在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com