
| A. | Fe3+、Al3+、SCN-、Cl- | B. | Fe3+、Na+、S2-、Cl- | ||
| C. | K+、H+、Cl-、AlO2- | D. | Na+、Ca2+、HCO3-、Cl- |
分析 A.铁离子与硫氰根离子反应生成硫氰化铁;
B.铁离子能够氧化硫离子;
C.氢离子与偏铝酸根离子反应;
D.四种离子之间不反应,能够共存.
解答 解:A.Fe3+和SCN-之间反应生成络合物硫氰化铁,在溶液中不能大量共存,故A错误;
B.Fe3+、S2-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.H+、AlO2-之间发生反应,在溶液中不能大量共存,故C错误;
D.Na+、Ca2+、HCO3-、Cl-之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | Mg、Al | B. | Mg、Fe | C. | Zn、Fe | D. | Al、Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
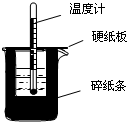 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型 | |
| B. | 在SCl2中,中心原子S采取sp杂化轨道成键 | |
| C. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| D. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水和1molH2的 体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气 体一定处于标准状况 | |
| D. | 在标准状况下,1molH2和O2的混合气体体积约是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在的离子为Fe3+、SO42- | |
| B. | 一定不存在的离子为CO32-、I- | |
| C. | 不能确定的离子为K+、SO42- | |
| D. | 确定是否含有K+离子需要经过焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com