
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:不详 题型:单选题
| A.原子序数为7 | B.周期表中第一电离能最小 |
| C.周期表中原子半径最大 | D.周期表中电负性最大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.零族元素的单质在常温下都是气体 |
| B.第ⅡA族元素都是金属元素 |
| C.Fe位于周期表的第四周期,第ⅧB族 |
| D.第ⅦA族元素的单质在常温下有气态、液态、固态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为: 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
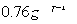 ;W的质子数是X、Y、Z、M四种元素质子数之和的
;W的质子数是X、Y、Z、M四种元素质子数之和的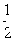 。下列说法正确的是
。下列说法正确的是| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 电离能/kJ·mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
 案:
案:
 100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。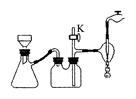
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 反应的化学方程式:____________________________。
反应的化学方程式:____________________________。A. (CN)2+2NaOH===NaCN+NaCNO+H2O (CN)2+2NaOH===NaCN+NaCNO+H2O | |
| B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O | C.I2+2KCN===2KI+(CN)2 |
| D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素代号[ | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.150 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 | +3 | +2 |
 、化学式回答下列问题:
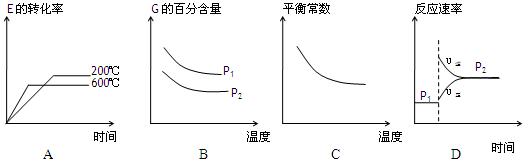
、化学式回答下列问题: 2G(g)根据下表中的数据判断下列图像错误的是 。
2G(g)根据下表中的数据判断下列图像错误的是 。 | p1(MPa) | P2(MPa) |
| 200 | 78.4 | 90.6 |
| 600 | 72.3 | 88.6 |
|
 II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。
II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。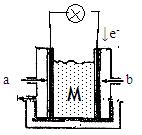
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com