
【题目】下列有关物质的量描述中不正确的是( )
A. 物质的量表示含有一定数目粒子的集合体
B. 物质的量的单位是摩尔
C. 0.012Kg12C中含有的碳原子的物质的量是1摩尔
D. 物质的量就是物质的质量
科目:高中化学 来源: 题型:
【题目】氯气的化学性质很活泼,在一定条件下能与很多无机物和有机物反应,生成多种多样的含氯化合物。
(1)查阅文献:重铬酸钾与浓盐酸反应可以制备氯气。反应原理如下:K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O
请在上述反应中标出电子转移的方向和数目。__________________
(2)图1是某同学制备氯水的装置图。

①装置B中发生反应的离子方程式为__________________。
②检验一瓶氯水是否已经完全变质,可选用的试剂是______________(填序号)。
A.硝酸银溶液B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液
(3)漂白粉或漂白精的有效成分为Ca(ClO)2,Ca(ClO)2能与空气中的CO2和水蒸气发生如下反应:Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO,分析以上反应,你认为存放漂白粉时应注意的问题有_________________________________________________。
(4)实验室欲用12 mol·L1的浓盐酸配制成250mL1.0 mol·L1的稀盐酸溶液。可供选择的仪器有:a.玻璃棒 b.烧瓶 c.烧杯 d.胶头滴管 e.量筒 f.托盘天平。
①上述仪器中,在配制稀盐酸溶液时不需要使用的有___________,还缺少的仪器是_____________。
②下列有关容量瓶的使用方法正确的是_____________(填代号)。
A.量筒量取浓盐酸试样后直接倒入容量瓶中,缓慢加水至接近刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线
B.配制一定体积、浓度的溶液时,容量瓶未干燥,对所配溶液浓度无影响
C.容量瓶用水洗净后,再用1.0 mol·L1的稀盐酸溶液润洗
D.使用容量瓶前检查它是否漏水
③根据计算,本实验需要量取浓盐酸的体积为______mL(计算结果保留一位小数)。
④对所配制的稀盐酸进行测定,发现浓度大于1.0mol/L。请你分析配制过程中可能引起浓度偏高的原因(答出两点)___________________、________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下: 
(1)金属M为 , 操作1为 .
(2)加入H2O2的作用是(用离子方程式表示) , 加入氨水的作用是 .
(3)充分焙烧的化学方程式为 .
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是 , 90℃时Ksp(Li2CO3)的值为 .
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL﹣1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号内试剂除去下列各物质中的少量杂质,正确的是( )
A.溴苯中的溴(KI溶液)
B.乙烷中的乙烯(酸性高锰酸钾)
C.乙酸乙酯中的乙酸(饱和Na2CO3溶液)
D.苯中的甲苯(Br2水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质可按溶解、过滤、蒸发的操作顺序进行分离的是( )
A. 氧化铜与氧化铁B. 硝酸钾与硝酸钠
C. 四氯化碳与汽油D. 硫酸钠与氯化银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.
(1)醋酸二胺合铜(I)可以除去原料气中的CO.Cu+基态核外电子排布式为 , 生成的CH3COO[Cu(NH3)3CO]中与Cu+形成配离子的配体为(填化学式).
(2)NH4NO3中N原子杂化轨道类型为 , 与NO3﹣互为等电子体的分子为(填化学式,举一例).
(3)1mol CO(NH2)2H2O2(过氧化尿素)中含有σ键的数目为 .
(4)钉(Ru)系催化剂是目前合成氨最先进的催化剂,一种钌的化合物晶胞结构如图所示,有关该晶体的说法正确的是(填字母).
a.晶胞中存在“RuO62﹣”正八面体结构
b.与每个Ba2+紧邻的O2﹣有12个
c.与每个O2﹣紧邻的Ru4+有6个
d.晶体的化学式为BaRuO3 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:

(1)写出A、B、C、D、E、F的化学式:
A.__________;B.__________;C.__________;
D.__________;E.__________;F.__________。
(2)写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
B → C:__________________________________________________________________,
E → B:___________________________________________________________________,
C → F:___________________________________________________________________,
F → C:___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图转化关系中A﹣H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体,已知单质乙、化合物A为黄色(或淡黄色)固体,乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程,B,F两种气体都能使澄清石灰水边浑浊(部分反应物或产物略去) 
(1)写出物质A的电子式: .
(2)写出下列物质的化学式:甲乙丙 .
(3)写出A与H2O溶液反应的离子方程式 .
丙与D溶液反应的化学方程式 .
乙与D溶液反应的化学方程式 .
(4)常温下,H可用丙材料的容器盛装的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯,如图1所示实验装置: 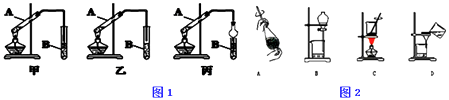
请回答下列问题:
(1)能完成本实验的装置是(从甲、乙、丙中选填)
(2)试管B中装入的液体为 . 试管B中发生反应的化学方程式为 .
(3)制取乙酸乙酯时加入试剂顺序为 , 发生反应的化学方程式为 .
(4)从制备乙酸乙酯所得的混合物中分离、提纯乙酸乙酯时,需要经过多步操作,下列图2示的操作中,肯定需要的化学操作是(选填答案编号).
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器.使用分液漏斗前必须;某同学在进行分液操作时,若发现液体流不下来,应采取的措施是
(6)用30g乙酸和40g乙醇反应,可以得到37.4g乙酸乙酯,则该实验的产率(产率指的是某种生成物的实际产量与理论产量的比值)是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com