
【题目】已知常温下,0.1molL﹣1的HA溶液中 ![]() =1×10﹣8 , 下列叙述中正确的是( )
=1×10﹣8 , 下列叙述中正确的是( )
A.0.01 molL﹣1HA的溶液中 c(H+)=l×l0﹣4molL﹣1
B.pH=3的HA溶液与pH=ll的NaOH溶液等体积混合后所得溶液中:c(Na+)=c(A﹣)>c(OH﹣)=c(H+)
C.浓度均为0.1 molL﹣1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(H+)﹣c(OH﹣)>c(A﹣)﹣c(HA)
D.pH=3的HA溶液与pH=11的NaOH溶液混合后所得溶液显碱性,则 c(Na+)>c(A﹣)>c(OH﹣)><c(H+)
【答案】D
【解析】解:常温下,0.1molL﹣1的HA溶液中 ![]() =1×10﹣8 , 而常温下,c(H+)c(OH﹣)=10﹣14 , 据此可以解得c(H+)=10﹣3mol/L,c(OH﹣)=10﹣11mol/L.可知HA为弱酸.A、0.1mol/L的HA溶液中c(H+)=10﹣3mol/L,由于HA为弱酸,加水稀释,电离平衡被促进,故当加水稀释至0.01mol/L时,溶液中氢离子浓度大于10﹣4mol/L,故A错误;
=1×10﹣8 , 而常温下,c(H+)c(OH﹣)=10﹣14 , 据此可以解得c(H+)=10﹣3mol/L,c(OH﹣)=10﹣11mol/L.可知HA为弱酸.A、0.1mol/L的HA溶液中c(H+)=10﹣3mol/L,由于HA为弱酸,加水稀释,电离平衡被促进,故当加水稀释至0.01mol/L时,溶液中氢离子浓度大于10﹣4mol/L,故A错误;
B、由于HA为弱酸,故pH=3的HA溶液与pH=ll的NaOH溶液等体积混合后HA过量,根据电离大于水解可知,溶液显酸性,故有c(H+)>c(OH﹣),根据电荷守恒可知,c(Na+)<c(A﹣),则应有:c(A﹣)>c(Na+)>c(H+)>c(OH﹣),故B错误;
C、浓度均为0.1 molL﹣1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,说明HA的电离程度大于NaA的水解程度,则c(A﹣)>c(HA)>c(H+)>c(OH﹣),故C错误;
D、pH=3的HA溶液与pH=11的NaOH溶液混合后所得溶液显碱性,则说明c(OH﹣)>c(H+),根据电荷守恒可知c(Na+)>c(A﹣),故有:c(Na+)>c(A﹣)>c(OH﹣)>c(H+),故D正确.
故选D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 沙子、石英、水晶的主要成分都是SiO2
B. 制玻璃、水泥的原料都用到石灰石
C. 硅在常温下不与氧气、氯气、硝酸反应
D. 一定条件下SiO2可与碱和氢氟酸反应,故其属于两性氧化物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装液润洗
B.用蒸馏法可由含有Fe3+的自来水获取较纯净的水
C.焰色反应后用稀盐酸洗涤铂丝并在火焰上灼烧至无色,再进行其它物质的测试
D.金属镁着火可用沙子覆盖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Fe+3Cl2 ![]() 2FeCl3 , 当28gFe在71gCl2中点燃时( )
2FeCl3 , 当28gFe在71gCl2中点燃时( )
A.Fe和Cl2恰好完全反应
B.生成99gFeCl3
C.会有9.33gFe过量
D.会有17.75gCl2过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内气体逐渐变为红棕色:N2O4(g)![]() 2NO2 (g)。下列结论不能说明上述反在该条件下已经达到平衡状态的是()
2NO2 (g)。下列结论不能说明上述反在该条件下已经达到平衡状态的是()
①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化 ④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变 ⑥烧瓶内气体的颜色不再变化
⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化。
A. ①③⑦ B. ①④⑧ C. ①②⑤ D. ④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,离子方程式书写正确的是( )
A.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO ![]() =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
B.泡沫灭火器的灭火原理:2Al3++3CO ![]() +3H2O=2Al(OH)3↓+3CO2↑
+3H2O=2Al(OH)3↓+3CO2↑
C.向硝酸银溶液中加入足量的氨水:Ag++2NH3?H2O=Ag(NH3)2++2H2O
D.用足量的氨水处理硫酸工业的尾气:SO2+NH3?H2O=NH ![]() +HSO
+HSO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)配制0.50mol/L NaOH溶液
a.若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
b.从图中选择称量NaOH固体所需要的仪器是(填字母): .
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.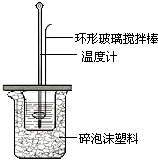
a.写出该反应的热化学方程式(中和热为57.3kJ/mol): .
b.取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用如图所示装置在实验室制取HCl气体.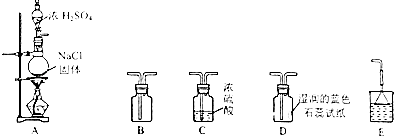
回答下列问题:
(1)装置A中微热时发生反应的化学方程式为 .
(2)若要使B中收集满干燥的HCl气体(并证实B中已收集满),则上述装置的连接顺序为:接接接接(用字母表示).
(3)实验发生以后装置D中观察到的现象是 .
(4)尾气吸收装置中加倒扣漏斗的目的是 .
(5)若将产生的HCl气体通入100g水中,得到溶质质量分数为26.74%的盐酸,则通入的HCl气体的体积在标准状况下为 L.
(6)气体发生在装置的选择要考虑反应物状态和反应条件等因素.实验室制取氧气(氯酸钾和二氧化锰)和二氧化碳的发生装置都不用装置A,其原因分别是、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
A. 敞口浓硫酸变重B. 敞口浓盐酸变稀
C. 裸露的铝片表面失去光泽D. 氢氧化钠的表面变潮湿
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com