
科目:高中化学 来源: 题型:选择题
| A. | 氢键、分子间作用力、离子键、共价键都是微粒间的作用力,其中氢键、离子键和共价键是化学键 | |
| B. | 石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 | |
| C. | 下列物质的熔沸点由大到小排列:晶体硅>碳化硅>金刚石 | |
| D. | 黄色晶体碳化铝,熔点2200℃,熔融态不导电,是原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L 水所含分子数目为 NA | |
| B. | 1mol•L-1K2SO4溶液所含 K+数目为 2NA | |
| C. | 1 mol 钠与氧气反应生成 Na2O 或 Na2O2时,失电子数目均为 NA | |
| D. | O2 的摩尔体积约为 22.4 L•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl=CaCl2+CO2↑+H2O | B. | CuO+2HCl=CuCl2+H2O | ||
| C. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | D. | NaOH+HCl=NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质 | B. | 分子 | C. | 原子 | D. | 离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数是受溶液的浓度、气体的压强、体系的温度等外界条件影响的 | |
| B. | 某电解质溶液中,温度升高,Kw增大,则溶液的酸性或碱性一定增强 | |
| C. | H2CO3的电离常数表达式:K=$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$ | |
| D. | 电离平衡常数可以表示弱电解质的相对强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
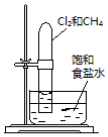 置于光亮处 置于光亮处 | 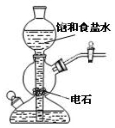 |
| A.验证甲烷与氯气发生化学反应 | B.实验室制乙炔 |
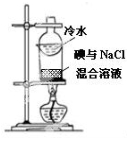 | 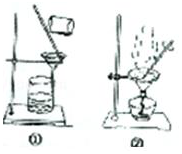 |
| C.从碘与氯化钠的混合溶液中分离碘 | D.粗苯甲酸的提纯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com