
����Ŀ��25 ��ʱ����Ũ��Ϊ0.1000 mol��L��1��NaOH��Һ�ζ�25.00 mLŨ�Ⱦ�Ϊ0.1000 mol��L��1��������HX��HY��HZ���ζ�������ͼ��ʾ������˵����ȷ���ǣ�
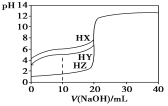
A������ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ�������˳��HZ��HY��HX
B�����ݵζ����ߣ��ɵ�Ka(HY)��1��10��5
C��������HX��HY��Һ�������Ϻ���NaOH��Һ�ζ���HXǡ����ȫ��Ӧʱ��
c(X��)��c(Y��)��c(OH��)��c(H��)
D��HY��HZ��ϣ��ﵽƽ��ʱc(H��)��![]() ��c(Z��)��c(OH��)
��c(Z��)��c(OH��)
���𰸡�B
��������
���������Ũ����ͬʱ����Խ��������̶�ԽС�����������H+Ũ��ԽС��PHԽ����δ����NaOH��֪������HZ��pH=1��HZ��ǿ�ᣬ��HY��HX��pH������1���������������ᣬ������HY��HX���ʵ�������ΪHZ��HY��HX��A��������HY��˵����ͼ֪��δ��NaOHʱ��c��H+��=10-3mol/L����HY��Ka����Ϊ10��3��10��3/0.1=10-5��B��ȷ����ǡ�á��кͣ�����HY����ǿ��HX������X-ˮ��̶ȴ���Y-��C����HY��HZ��ϣ���Һ�ĵ���غ�ʽΪ��c(H+)= c(Y��)+ c(Z��)+c(OH��)���ָ���HY�ĵ���ƽ�ⳣ����Ka(HY)=c(H+)c(Y-)/c(HY)��c(Y-)=Ka(HY)c(HY)/c(H+)����������ɵ�ʽ���ɵ�c(H+)= c(Y-)Ka(HY)c(HY)/c(H+)+c(Z-)+c(OH-)��D������ѡB��


 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ʢ��NaOH��Һ���Լ�ƿӦѡ��
A. ϸ�������Լ�ƿ B. ϸ�ڲ������Լ�ƿ
C. ��������Լ�ƿ D. ��ڲ������Լ�ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β������Ҫ�ɷ���CO��SO2����������ȣ����й�����Ŀǰ���ڳ����Զ�������(TiO2)���ֽ�����β�����о���
��1����֪��2NO(g)+O2(g)=2NO2(g) ��H1=-113.0KJ/mol
2SO2(g)+O2(g)=2SO3(1) ��H2=-288.4KJ/mol
N2(g) + O2(g) = 2NO(g) �� H3����180.5 kJ��mol��1
���жϷ�ӦNO2(g)+SO2(g)=NO(g)+SO3(1) ��H4,�ڵ������ܷ��Է����У���˵������______________________��
��2����֪TiO2��β������ԭ��Ϊ��2CO(g)+O2(g) ![]() 2CO2(g)�� 2H2O(g)+4NO(g)+O2(g)
2CO2(g)�� 2H2O(g)+4NO(g)+O2(g) ![]() 4HNO3(g)��
4HNO3(g)��
��.��O2Ũ�ȼ�������������£�ģ��CO��NO�Ľ��⣬�õ���������ʱ��仯��ͼ1��ʾ��![]() ������Ӧ40�����HNO3����Ũ���������ͣ����û�ѧ����ʽ��ϻ�ѧ��Ӧԭ��֪ʶ���ͳ��ָ�������ܵ�ԭ��_______________________��
������Ӧ40�����HNO3����Ũ���������ͣ����û�ѧ����ʽ��ϻ�ѧ��Ӧԭ��֪ʶ���ͳ��ָ�������ܵ�ԭ��_______________________��
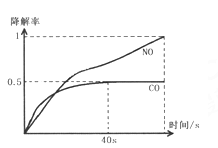
��.ͼ2Ϊ�ڲ�ͬ������϶��������������������ͣ��Ͳ�ͬ�¶��£�ʵ�������ͬһ��ʱ�䣨t�룩���õ�CO�����ʱ仯���ش�л�����⣺
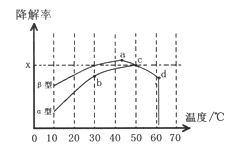
����֪50����t��ʱ������O2Ũ��Ϊ0.01mol/L������¶���CO���ⷴӦ��ƽ�ⳣ��_______��
�����й���ͼ2����������ȷ����_________
A.���ݽ�������b�㵽c�����¶ȵ����߶�����֪CO���ⷴӦ��ƽ�ⳣ��Kb<Kc
B.��ͬ�¶������������������CO�������ʱ�����Ҫ��
C.a������ݷ�ӳ��CO��O2֮������������Ч��ײƵ��������ʵ���������ߵ�
D.d�㽵���ʳ���ͻ���ԭ��������¶����ߺ����ʧЧ
�ۿ����Ŷ��������������������Ϊ���壬��TiO2��Ϊ��Ч�����õ�TiO2���ܣ���10-60����Χ�ڽ���ʵ�飬����ͼ2�����߶�����Ӱ������ʾ��������CO���������¶ȱ仯�����߿��ܳ��ֵ��������Χ��ʾ����![]() ����________________________
����________________________
��3��TiO2���ܵ��Ʊ�����������ˮ��Һ���Խ�����Ϊ�������е�⣬д�������ĵ缫��Ӧʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ָ�Ч������Ư������Ҫ�����ġ����顢ֽ��Ư�ס�ʳƷ������ˮ������ɱ���������ҩ���졣ij��ѧ��ȤС���������������о�����ش��������⡣
��֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2��3H2O������38��ʱ�����ľ�����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaC1��
(1)��������������������Ư��ԭ����ͬ����_______��
A.H2O2 B.NaClO C.SO2 D.Al(OH)3����
(2)��������ͼ��ʾװ��(�г�װ��ʡ��)������ȡNaClO2����ʵ�顣
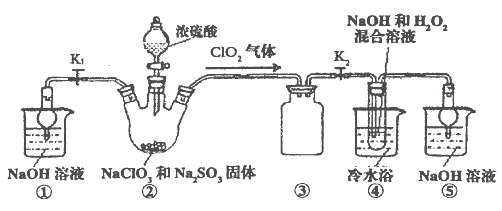
a.װ����������ʵ�����������Ʒֱ���_____________��___________��
b.װ�����в���ClO2�Ļ�ѧ����ʽΪ_________________________��
װ�������Ʊ�NaClO2�����ӷ���ʽΪ________________________��
c.װ������������________________��
d.δ��Ӧ���ClO2��װ�����пɱ�NaOH��Һ���գ����ɵ����������뻹ԭ�����Ϊ�������Σ��Ҷ��ߵ����ʵ���֮��Ϊ1��1����д���÷�Ӧ�����ӷ���ʽ______________________��
e.��װ������Ӧ�����Һ���NaClO2����IJ����������£�
����ѹ��55�������ᾧ�������ȹ��ˣ���___________��������60������õ���Ʒ��
(3)������ʵ�鷽���ⶨ����������Ʒ�Ĵ��ȡ�
����������Ʒ���Ȳⶨʵ���õ��Ļ�ѧ��Ӧ����ʽΪClO2-+4I-+4H+=2H2O+2I2+Cl-��I2+2S2O32-=2I-+S4O62-
a.�òⶨʵ���õ���ָʾ��Ϊ_________________��
b.Ϊ�ⶨ����������Ʒ���ȣ���Ҫ�õ�����ʵ�������е�___________(��дѡ����ĸ��
A.����������Ʒ������(a g)
B.�����ĵ⻯�ؾ��������(b g)
C.ϡ�����Ũ��(cmol/L)�����(D mL)
D.ָʾ���ļ�����(d mol)
E.��Һ��Ũ�ȣ�e mol/L�������������VmL��
������ѡ�������ݱ�ʾ����Ʒ��NaC1O2 ��������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2L���ܱ������У�����1molX(g)��2molY(g)������Ӧ��X(g)+m Y(g)![]() 3Z(g)��ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1molZ(g)���ٴδﵽƽ���X��Y��Z������������䡣������������ȷ����
3Z(g)��ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1molZ(g)���ٴδﵽƽ���X��Y��Z������������䡣������������ȷ����
A��m=2
B������ƽ���ƽ�ⳣ����ͬ
C��X��Y��ƽ��ת����֮��Ϊ1:1
D���ڶ���ƽ��ʱ��Z��Ũ��Ϊ0.4 mol�qL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˿���Դ����ίԱ�ḱ���Ρ��й���ѧԺԺʿ�ش�ӱ�ʾ����ǰ�����ɢ��ú��û������ú������й������������߶�����������Ҫԭ��ú�������ǽ����������������ú̿����Ҫ;��֮һ��
����֪:H2O(g)=H2O(I) ��H=-44kJ/mol
���� | H2(g) | C(s) | CO(g) |
ȼ����kJ/mol | -285.8 | -393.5 | -283.0 |
����д��ú��������Ӧ���ɺϳ���(CO��H2)���Ȼ�ѧ����ʽ___________��
���ں��¡����ݵķ�Ӧ���У��ܱ���������Ӧ�ﵽƽ��״̬����_______��
a.�������ƽ����Է����������ٸı�
b.����ѹǿ���ٸı�
c.������Ũ�����
d.��Ӧ��ϵ���¶ȱ��ֲ���
e.���������������Ƕ�����������ʵ�2��
f.��������ܶȲ���
g.��λʱ���ڣ�����ˮ������������������������Ϊ9��1
���ڴ��������ºϳ����ϳɼ�������лᷢ�����·�Ӧ��
I CO(g)+3H2(g) = CH4(g)+H2O(g) ��H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) ��H2= -41 kJ/mol
�� 2CO(g)+2H2(g)= CH4(g)+CO2(g) ��H 3= -247.4 kJ/mol
��ͼ1��̫ԭ������ѧú�����о�����������ѧ���ݷ����õ��¶ȶԷ�Ӧ��InK(��ѧƽ�ⳣ��K����Ȼ����)������ͼ,����������������Ƶ�ԭ����____________��

������鷴Ӧѡ���ԵĹؼ�������_______���������֪ʶ��ͼ2�����ϳɼ������˵ķ�Ӧ������
��550��630K��1MPa��ԭ����__________________��
��850��ʱ�����Ϊ5L��Ӧ���з�����Ӧ��CO��H2O(g)Ũ�ȱ仯��ͼ��ʾ������ʽ����������µ�ƽ�ⳣ��_____________ ��
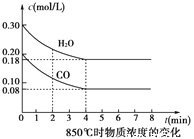
(3)CH4ȼ�ϵ�������ʺܸߣ�װ��������1L2mol/L��KOH��ҺΪ����ʣ���������ͨ���״���¼���22.4L��33.6 Lʱ�����缫��ӦΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������[CO(NH2)2]��һ�ָ�Ч���ʣ�Ҳ��һ�ֻ���ԭ�ϡ�
��1�����º����£���ij�ܱ������г���CO(NH2)2��H2O����120�������������·�����Ӧ��CO(NH2)2 (s) + H2O(g)![]() 2 NH3(g)+CO2(g) ��H >0���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK= ��
2 NH3(g)+CO2(g) ��H >0���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK= ��
���ڸ÷�Ӧ������˵����ȷ����
A����������ƽ����Է����������ٸı䣬������Ϊ��ѧƽ���ı�־
B����ƽ����ϵ������ˮ��������ʹ�÷�Ӧ��ƽ�ⳣ������
C�������¶�ʹCO(NH2)2��ת��������
D���ﵽƽ����ٳ�������H2O�����´ﵽƽ�⣬H2O��ת���ʻ��С
��2��һ�������£�ij�ܱ������г�������ʵ�����NH3��CO2��������Ӧ��CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g)�����������NH3���������[��(NH3)]��ʱ��仯��ϵ��ͼ��ʾ��
CO (NH2)2 (s) +H2O(g)�����������NH3���������[��(NH3)]��ʱ��仯��ϵ��ͼ��ʾ��
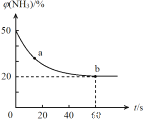
��a�������Ӧ����V��(CO2)_________ b����淴Ӧ����V��(CO2)(�>������=����<��)��������ƽ��ת������___________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A���ְ��п���Է�ֹ��ʴ
B����ë����˿��������Ҫ�ɷֶ�����ά��
C���ߴ�ʯӢ����������������ά
D����������ͨ�ֶ�����̼�Ͻ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com