
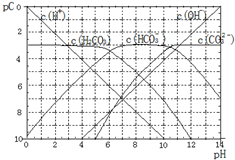
| A. | 某温度下,CO2饱和溶液的浓度是0.05mol•L-1,其中$\frac{1}{5}$的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% | |
| B. | 25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6 | |
| C. | 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO${\;}_{3}^{2-}$)+c(OH-)+c(HCO${\;}_{3}^{-}$) | |
| D. | 25℃时,0.1mol/LNa2CO3中C(HCO${\;}_{3}^{-}$)比0.1mol/LH2CO3中C(HCO${\;}_{3}^{-}$)大 |
分析 A.某温度下,CO2饱和溶液的浓度是0.05mol•L-1,H2CO3的浓度为0.01mol/L,电离度为$\frac{1{0}^{-5}}{0.01}$×100%;
B.由图象可知当pH=6时,pC(H2CO3)=pC(HCO3-),结合Ka1(H2CO3)=$\frac{c({H}^{+})×c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$计算;
C.根据电荷守恒分析;
D.不知道Na2CO3的水解程度与H2CO3的电离程度关系,无法比较.
解答 解:A.某温度下,CO2饱和溶液的浓度是0.05mol•L-1,其中$\frac{1}{5}$的CO2转变为H2CO3,则H2CO3的浓度为0.01mol/L,电离度为$\frac{1{0}^{-5}}{0.01}$×100%=0.1%,故A正确;
B.由图象可知当pH=6时,c(H+)=10-6mol/L,pC(H2CO3)=pC(HCO3-),Ka1(H2CO3)=$\frac{c({H}^{+})×c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=10-6,故B正确;
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(HCO3-)+2c(CO32-),故C错误;
D.不知道Na2CO3的水解程度与H2CO3的电离程度关系,无法比较0.1mol/LNa2CO3中C(HCO3-)与0.1mol/LH2CO3中C(HCO3-)的关系,故D错误.
故选CD.
点评 本题考查了弱电解质的电离,明确图象中Pc的含义是解本题关键,再结合pH、Pc的关系来分析解答,题目难度中等,侧重于考查学生对基础知识的应用能力和对图象的分析能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>d | B. | 氢化物的稳定性:H2Y>HZ | ||
| C. | 离子的氧化性:X+<W3+ | D. | 原子半径:X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
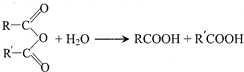
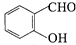 中的官能团名称为醛基、羟基
中的官能团名称为醛基、羟基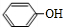 ,DCH3COOH,G
,DCH3COOH,G

 )氮原子上的氢原子可以像A上的氢原子一样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
)氮原子上的氢原子可以像A上的氢原子一样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式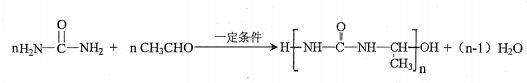
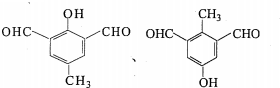 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=1.0×10-2mol•L-1 | |
| B. | 醋酸的电离平衡常数Ka=c(CH3COO-)•c(H+) | |
| C. | 若将溶液的温度升高到100℃,c(OH-)减小 | |
| D. | 加水稀释后H+的物质的量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程的离子方程式:2Cu2++3SO32-→Cu2O↓+SO42-+2SO2↑ | |
| B. | 反应过程的离子方程式:2Cu2++3SO32-+2H2O→Cu2O↓+SO42-+4H+ | |
| C. | 加入过量Na2SO3有利于控制溶液的pH | |
| D. | 在酸性条件下,若有14.4g Cu2O变质,转移电子0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿中加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 待水分完全蒸干后停止加热 | |
| D. | 蒸干水分后用玻璃棒转移固体至滤纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
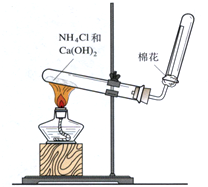 (1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com