
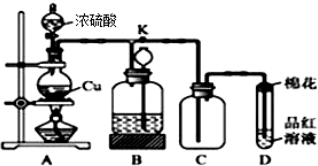
分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水;
(2)二氧化硫具有漂白性,遇到品红试液会使其褪色;二氧化硫有毒,直接排放能够引起空气污染,二氧化硫能够与氢氧化钠溶液反应,可以用浸有NaOH溶液的棉团塞在试管口吸收二氧化硫;
(3)B中液体不与二氧化硫反应,也不溶解二氧化硫,关闭旋塞K,移去酒精灯,但由于余热的作用,生成气体导致装置B中压强增大液体被压入长颈漏斗,据此进行分析;
(4)稀硫酸和铜不发生反应,通入氧气后能够反应生成硫酸铜,据此写出反应的化学方程式.
解答 解:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,化学方程式:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+2H2O+SO2↑;
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+2H2O+SO2↑;
(2)二氧化硫具有漂白性,遇到品红试液会使其褪色;二氧化硫有毒,直接排放能够引起空气污染,二氧化硫能够与氢氧化钠溶液反应,可以用浸有NaOH溶液的棉团塞在试管口吸收二氧化硫;
故答案为;品红褪色; NaOH溶液;吸收多余SO2气体;
(3)装置B的作用是贮存多余的气体,所以B中应放置的液体不能与二氧化硫反应,也不能溶解二氧化硫,而a.饱和Na2SO3溶液、b.酸性KMnO4溶液、c.浓溴水都能够与二氧化硫反应,只有d.饱和NaHSO3溶液符合要求,生成气体导致装置B中压强增大液体被压入长颈漏斗,
故答案为:d;
(4 )实验中甲学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该气体单质具有强氧化性,又是常见的,可以为氧气;铜和氧气、稀硫酸发生氧化还原反应,得到硫酸铜和水,反应的化学方程式为:2Cu+O2+2H2SO4═2CuSO4+2H2O,
故答案为:O2;2Cu+O2+2H2SO4═2CuSO4+2H2O.
点评 本题考查了浓硫酸性质的分析应用,生成二氧化硫的还原性、漂白性是分析关键,注意浓硫酸随反应进行变化为稀硫酸不与铜发生反应,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 正戊烷与2,2-二甲基丙烷互为同分异构体 | |
| B. | 乙醇和二甲醚互为同分异构体 | |
| C. | 乙醇、乙二醇、丙三醇互为同系物 | |
| D. | 可用溴水来区分乙醇和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氢量:苯>乙烯>甲烷 | |
| B. | 密度:H 2O>溴苯>苯 | |
| C. | 沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 | |
| D. | 等质量的下列物质燃烧耗O 2量:乙炔>乙烯>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中有下列平衡:Br2+H2O?HBr+HBrO当加入AgNO3(s)后溶液颜色变浅 | |
| B. | 2NO2(g)?N2O4(g)△H<0,升高温度可使体系颜色加深 | |
| C. | 反应N2+3H2?2NH3△H<0,增大压强可提高N2的转化率 | |
| D. | 合成氨反应CO+NO2?CO2+NO△H>0中使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖(C6H12O6)与蔗糖(C12H22O11) | B. | 醋酸与甲酸甲酯(C2H4O2) | ||
| C. | 乙醇与甲醛(CH2O) | D. | 二甲醚(C2H6O)与乳酸(C3H6O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
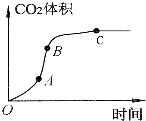 某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是( )
某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是( )| A. | AB段反应速率最快的原因可能是反应放热,体系温度升高 | |
| B. | BC段反应速率变慢的原因可能是盐酸浓度降低 | |
| C. | 该反应速率也可以用CaCl2的浓度变化与时间关系来表示 | |
| D. | C点后CO2体积不变的原因一定是大理石消耗完 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1-△H2 | B. | △H2-△H1 | C. | △H1+△H2 | D. | -(△H1-△H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com