
碳和硅属于同主族元素,在生活生产中有着广泛的用途。
(1)甲烷可用作燃料电池,将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池,通入CH4的一极,其电极反应式是 ;
CH4催化还原NOX可以消除氮氧化物的污染,有望解决汽车尾气污染问题,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则NO2被甲烷还原为N2的热化学方程式为_____________________________________
(2)已知H2CO3 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3- CO32-+H+ Ka2(HCO3-)=5.61×10-11
CO32-+H+ Ka2(HCO3-)=5.61×10-11
HA H++A- Ka(HA)=2.95×10-8
H++A- Ka(HA)=2.95×10-8
请依据以上电离平衡常数,写出少量CO2通入到NaA溶液中的离子方程式
___________________________。
(3) 在T温度时,将1.0molCO2和3.0molH2充入2L密闭恒容器中,可发生反应的方程式为CO2 (g) + 3H2(g)  CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转 化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转 化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英(SiO2)与焦炭在高温的氮气流中反应生成,已知该反应的平衡常数表达式K=[c(CO)]6/[c(N2)]2,若已知CO生成速率为v(CO)=6mol·L-1·min-1,则N2消耗速率为v(N2)= ;该反应的化学方程式为________________________________________。
(1) CH4-8e-+ 10OH-=CO32-+ 7H2O
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1(3分,方程式1分,数值2分)
(2) CO2+ A-+ H2O = HCO3-+ HA
(3) 400(1-a)%或4(1-a)×100%或(4-4a)×100%(3分,没有表示为百分号形式的不得分)
8/27 L/mol (3分,没有单位或单位错误扣1分)
(4) 2mol·L-1·min-1(3分,没有单位或单位错误扣1分);
3SiO2+6C+ 2N2 Si3N4+ 6CO(没写可逆符号或缺少条件的扣1分)
Si3N4+ 6CO(没写可逆符号或缺少条件的扣1分)
解析试题分析:(1)甲烷在碱性条件下失电子生成CO32?,配平可得电极方程式:CH4-8e-+ 10OH-=CO32-+ 7H2O;首先写出NO2与CH4反应的化学方程式并注明状态,然后根据盖斯定律求?H,第二个反应对比N2,第一个反应与第二个反应抵消NO,所以?H=1/2?H1+1/2?H2=-867kJ·mol-1,进而写出热化学方程式。
(2)根据题目所给信息可知:Ka1(H2CO3)> Ka(HA) > Ka2(HCO3-),根据强酸制弱酸的原理,少量CO2通入到NaA溶液中的离子方程式为:CO2+ A-+ H2O = HCO3-+ HA
(3)因为压强之比等于气体物质的量之比,设CO2的转化率为x,根据三段式进行计算:
CO2 (g) + 3H2(g)  CH3OH(g) + 2H2O(g)
CH3OH(g) + 2H2O(g)
起始物质的量(mol) 1 3 0 0
转化物质的量(mol) x 3x x 2x
平衡物质的量(mol) 1-x 3-3x x 2x
则(4-x):4=a:1,解得x=4-4a,所以CO2的转化率为:400(1-a)%或4(1-a)×100%或(4-4a)×100%;
a=0.875时,x=0.5,则平衡常数为:0.5mol/L×(1mol?L?1)2÷[0.5mol/L×(1.5mol?L?1)3]="8/27" L/mol。
(4)根据平衡常数表达式K=[c(CO)]6/[c(N2)]2,可得化学方程式中CO的系数为6,N2的系数为2,反应物还有SiO2和C,生成了Si3N4,配平可得化学方程式:3SiO2+6C+ 2N2 Si3N4+ 6CO;v(N2)=1/3 v(CO)=6mol·L-1·min-1×1/3= 2mol·L-1·min-1。
Si3N4+ 6CO;v(N2)=1/3 v(CO)=6mol·L-1·min-1×1/3= 2mol·L-1·min-1。
考点:本题考查电极方程式、离子方程式、化学方程式、热化学方程式的书写、化学平衡常数、化学反应速率、转化率的计算。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
(1)1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,表示生成1 mol H2O的热化学方程式为_________________________
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的标准燃烧热为____________kJ·mol-1,该反应的热化学方程式为_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3 (l)+ H2O (l)+ CO2 (g) (NH4)2CO3 (aq) △H1
(NH4)2CO3 (aq) △H1
反应Ⅱ:NH3 (l)+ H2O (l)+ CO2 (g) NH4HCO3 (aq) △H2
NH4HCO3 (aq) △H2
反应Ⅲ:(NH4)2CO3 (aq) + H2O (l)+ CO2 (g) 2NH4HCO3 (aq) △H3
2NH4HCO3 (aq) △H3
请回答下列问题:
(1)△H1与△H2、△H3之间的关系是:△H3= 。
(2)为研究温度对(NH4)2CO3捕获CO2气体效率的影响,在温度为T1、T2、T3、T4、T5的条件下,将等体积等浓度的(NH4)2CO3溶液分别置于等体积的密闭容器中,并充入等量的CO2气体,经过相同时间测得容器中CO2气体的浓度,得趋势图(下图1)。则:
①△H3______0 (填“>”、“=”或“<”)。
②温度高于T3,不利于CO2的捕获,原因是 。
③反应Ⅲ在温度为K1时,溶液pH随时间变化的趋势曲线如下图2所示。当时间到达t1时,将该反应体系温度迅速上升到K2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化趋势曲线。
|

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
(1)如图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式____________________。
(热量用E1、E2或E3表示)。该图中的实线与虚线部分是什么反应条件发生了变化?
(2)在一定温度下,若将4a mol H2和2amol N2放入VL的密闭容器中,5分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为__________摩尔/(升?秒)。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是_____(填“正向移动”“逆向移动”或“不移动”)
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是
| A.c(NH4+)/c(NH3?H2O) | B.c(NH3?H2O)/c(OH-) |
| C.c(H+)/c(NH4+) | D.c(OH-)/c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
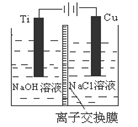
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
 △H >0
△H >0| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 =" +173.0" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
②某含C、H、O三种元素的有机物A,经测定碳的质量分数为52.16%,氢的质量分数13.14%,它可以作燃料电池(以KOH溶液为电解液)的原料,写出该电池的负极反应式 。
(2)某实验将CO2和H2充入一定体积的密闭容器中,发生反应:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H =-49.0 kJ·mol-1
CH3OH(g) +H2O(g) △H =-49.0 kJ·mol-1
回答问题:
①该反应的平衡常数表达式为 。
②把0.5mol的CO2和1.5mol的H2充入2L的密闭容器中,半分钟后测得c(H2)=0.15mol/L,用CH3OH表示该反应的速率:v(CH3OH)=
③如图,在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”, “减小”或“不变”)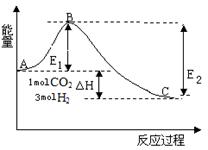
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一个小烧杯里加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10 g氯化铵晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:
(1)写出反应的化学方程式: _____________________________。
(2)实验中要立即用玻璃棒迅速搅拌的原因是_____________________________。
(3)如果实验中没有看到“结冰”现象,可能的原因是(答出三个或三个以上原因)__________________________ _____________。
(4)如果没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?
_______________________________________(答出两种方案)。
(5)“结冰”现象说明该反应是一个________(填“放出”或“吸收”)能量的反应。即断开旧化学键________(填“吸收”或“放出”)的能量________(填“>”或“<”)形成新化学键________(填“吸收”或“放出”)的能量。
(6)该反应在常温下就可进行,说明_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com