
| A. | KW是常温时的10-2倍 | B. | 温度不变冲稀10倍,pH=7 | ||
| C. | pH=6显弱酸性 | D. | c(H+)=10-6mol/L,溶液为中性 |
分析 溶液的酸碱性取决于C(H+)和C(OH-)的相对大小,如果C(H+)=C(OH-)时,溶液呈中性,C(H+)>C(OH-)时溶液呈酸性,C(H+)<C(OH-)时溶液呈碱性,不能根据溶液pH的大小确定溶液的酸碱性,水的离子积常数只与温度有关,与溶液的酸碱性无关,且温度越高,水的离子积常数越大.
解答 解:A.100℃时,KW=1×10-12,常温时,KW=1×10-14,所以KW是常温时的100倍,故A错误;
B.温度不变,水的离子积常数不变,则pH也不变,故B错误;
C.100℃时,C(H+)=C(OH-)=$\sqrt{Kw}$=10-6 mol/L,溶液呈中性,故C错误;
D.100℃时,C(H+)=C(OH-)=$\sqrt{Kw}$=10-6 mol/L,则纯水的pH=6,所以pH=6显中性,故D正确;
故选D.
点评 本题考查了溶液的酸碱性与离子积常数等知识,注意溶液的酸碱性取决于C(H+)和C(OH-)的相对大小,不取决于溶液pH的大小,为易错点.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂没有固定的熔沸点 | |
| B. | 糖类都能发生水解反应 | |
| C. | 蛋白质溶液中加入浓盐酸颜色变黄 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定相同 | B. | 一定不同 | C. | 可能不同 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的能量一定低于X的,N的能量一定低于Y的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中化学键吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | M和N的总能量一定低于X和Y的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组根据氧化还原反应规律,欲探究NO2、NO与Na2O2反应的情况.
某研究性学习小组根据氧化还原反应规律,欲探究NO2、NO与Na2O2反应的情况.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
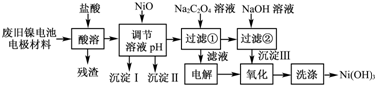
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com