
铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.0 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:
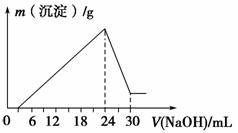
(1)写出滴加NaOH溶液24~30 mL时发生反应的离子方程式:______________________________。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为________,其物质的量为______________。
(3)该“钒土矿”样中Al2O3的质量分数为________。
(4)工业上制取金属铝的化学反应原理可表示为
2Al2O3(熔融)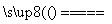 4Al+3O2↑
4Al+3O2↑
用10.0 t “钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上最多可制得金属铝________ t,假定Al2O3在熔融状态完全电离为Al3+和O2-,则电解过程的阳极反应式为_____________________ ___________________________________________________。
解析 (1)滴加NaOH溶液24~30 mL段Al(OH)3逐渐溶解,离子方程式为Al(OH)3+OH-===AlO +2H2O。(2)①中加入过量盐酸过滤后得到的滤液中含有AlCl3、FeCl3和HCl,不溶残渣为SiO2,②中滴加NaOH溶液至过量得到的沉淀为Fe(OH)3,溶液中含有NaOH、NaAlO2和NaCl。根据24~30 mL段,n(Al3+)=n[Al(OH)3]=2.0 mol·L-1×(30-24)×10-3 L=0.012 mol,根据Fe3++3OH-===Fe(OH)3↓、Al3++3OH-===Al(OH)3↓,则3n(Al3+)+3n(Fe3+)=(24-3)×10-3 L×2.0 mol·L-1=0.042 mol,故n(Fe3+)=(0.042 mol-0.012 mol×3)×
+2H2O。(2)①中加入过量盐酸过滤后得到的滤液中含有AlCl3、FeCl3和HCl,不溶残渣为SiO2,②中滴加NaOH溶液至过量得到的沉淀为Fe(OH)3,溶液中含有NaOH、NaAlO2和NaCl。根据24~30 mL段,n(Al3+)=n[Al(OH)3]=2.0 mol·L-1×(30-24)×10-3 L=0.012 mol,根据Fe3++3OH-===Fe(OH)3↓、Al3++3OH-===Al(OH)3↓,则3n(Al3+)+3n(Fe3+)=(24-3)×10-3 L×2.0 mol·L-1=0.042 mol,故n(Fe3+)=(0.042 mol-0.012 mol×3)× =0.002 mol,故Fe(OH)3=0.002 mol。
=0.002 mol,故Fe(OH)3=0.002 mol。
(3)10.0 g矿样中n(Al2O3)=0.012 mol×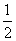 ×10=0.06 mol,故Al2O3的质量分数为
×10=0.06 mol,故Al2O3的质量分数为
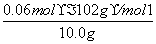 ×100%=61.2%。
×100%=61.2%。
(4)根据Al2O3~2Al,用10.0 t “钒土矿”样提纯并电解,制得金属铝的质量为10.0 t×61.2%× =3.24 t。电解熔融Al2O3时阳极为O2-放电,电极反应式为2O2--4e-===O2↑。
=3.24 t。电解熔融Al2O3时阳极为O2-放电,电极反应式为2O2--4e-===O2↑。
答案 (1)Al(OH)3+OH-===AlO +2H2O
+2H2O
(2)Fe(OH)3 2.00×10-3 mol
(3)61.2% (4)3.24 2O2--4e-===O2↑


科目:高中化学 来源: 题型:
某化学兴趣小组利用MnO2和浓HCl及如图装置制备Cl2。下列分析中不正确的是 ( )。
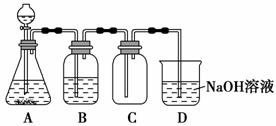
A.A中应用分液漏斗代替长颈漏斗
B.A中缺少加热装置
C.B中盛放的NaOH溶液可以净化Cl2
D.D中的导管口若连接倒置漏斗可防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性条件下有如下反应:2Cu+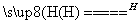 Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物做了验证,实验操作和实验现象记录如下:
Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物做了验证,实验操作和实验现象记录如下:
| 加入 试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验 现象 | 红色固体和 蓝色溶液 | 无色气体和 蓝色溶液 | 无色气体和 蓝色溶液 | 红棕色气体 和蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物是 ( )。
A.Cu
B.Cu2O
C.一定有Cu,可能有Cu2O
D.一定有Cu2O,可能有Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用。下列说法中错误的是 ( )。
A.MgO、Al2O3的熔点很高,可制作耐高温材料,工业上也用其电解冶炼对应的金属
B.明矾水解形成的胶体能吸附水中悬浮物,可用于水的净化
C.燃放烟花是利用了某些金属元素的焰色反应
D.铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是 ( )。
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的Na2O2和NaHCO3混合后,在密闭容器中加热充分反应,排出气体,冷却后有固体物质剩余,下列选项不正确的是 ( )。
| Na2O2/mol | NaHCO3/mol | 剩余的固体物质 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2 Na2CO3 |
| C | 2 | 1 | Na2O2 NaOH Na2CO3 |
| D | 2 | 2 | NaOH Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
烧碱、纯碱等都是重要的化工原料。
(1)利用如图装置可以证明二氧化碳与烧碱溶液发生了反应。
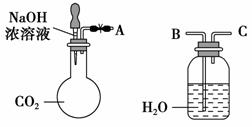
①若将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是_______________________________________________。
②若其他操作不变,将A与C连接,可观察到的现象是______________________________________________。
(2)向100 mL 1 mol·L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是Ⅰ.NaOH、Na2CO3,Ⅱ.__________________,Ⅲ.Na2CO3、NaHCO3,Ⅳ.__________________________________________。
①常温下,将得到的固体X重新溶于水,在所得溶液中加入盐酸,使溶液的pH=7,再将溶液蒸干,得到固体的质量为________ g。
②若要验证白色固体X是第Ⅰ种组成,依次加入的试剂为________(填字母序号)。
a.盐酸 b.MgCl2溶液
c.BaCl2溶液 d.Ba(OH)2溶液
在验证的过程中,一定需要进行的操作是________(填字母序号)。
a.萃取 b.洗涤
c.过滤 d.分馏
③若白色固体X为第Ⅲ种组成,下列实验方案中不能测定其中NaHCO3质量分数的是________(填字母序号)。
a.取m g X与足量Ba(OH)2溶液充分反应,过滤,洗涤,烘干得n g固体
b.取m g X与足量盐酸充分反应,加热,蒸干,灼烧得n g固体
c.取m g X充分加热,减重n g
d.取m g X与足量稀硫酸充分反应,逸出的气体被足量碱石灰吸收,增重n g
④若白色固体X的质量为7.0 g,则X的组成为________(填“Ⅰ”、“Ⅱ”、“Ⅲ”或“Ⅳ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用钠融法可定性确定有机物中是否存在氯、溴、硫、氮等元素。下列有关有机物与足量钠反应,各元素的转化结果正确的是( )
A.碳元素转化为NaCN B.氯元素转化为高氯酸钠
C.溴元素转化为溴化钠 D.硫元素转化为硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
已知14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将
A.大于40% B.等于40% C.小于40% D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com