
”¾ĢāÄæ”æ°“ÕÕŅŖĒó¼ĘĖć£ŗ
¢Ł19.6æĖĮņĖįŗ¬ÓŠ_____molŃõŌ×Ó£¬½«ÕāŠ©ĮņĖįČÜÓŚĖ®Åä³É500mLČÜŅŗ£¬“ÓĘäÖŠČ”³ö100mLæÉŅŌĻūŗÄ1mol/LµÄNaOHČÜŅŗ______mL”£
¢Ś__gH2O2Ėłŗ¬Ō×ÓŹżÓė0.2molH3PO4Ėłŗ¬Ō×ÓŹżĻąµČ£¬øĆH2O2ÖŠĖłŗ¬ÖŹ×ÓŹżĪŖ__£¬¼ŁÉčŅ»øöĢśŌ×ÓµÄÖŹĮæĪŖaæĖ£¬ÄĒĆ“ĘäĻą¶ŌŌ×ÓÖŹĮææɱķŹ¾ĪŖ__£Ø°¢·ü¼ÓµĀĀŽ³£ŹżĪŖNA£©”£
¢ŪŌŚ±ź×¼×“æöĻĀ£¬ĆܶČĪŖ0.75g/LµÄ°±ĘųŗĶ¼×ĶéµÄ»ģŗĻĘųĢåÖŠ£¬°±ĘųµÄĢå»ż·ÖŹżĪŖ_____£¬øĆ»ģŗĻĘųĢå¶ŌĒāĘųµÄĻą¶ŌĆܶČĪŖ______”£
¢ÜŅŃÖŖagAŗĶbgBĒ”ŗĆĶźČ«·“Ӧɜ³É0.2molCŗĶdgD£¬ŌņCµÄĦ¶ūÖŹĮæĪŖ__”£
¢Ż½«MgCl2”¤xH2OµÄ¾§Ģå4.06gČÜÓŚĖ®Åä³É100mLČÜŅŗ£¬Č”³ö50mLČÜŅŗÕżŗĆÓė0.02moLµÄAgNO3ČÜŅŗĶźČ«×÷ÓĆ£¬4.06gµÄMgCl2”¤xH2OĪļÖŹµÄĮæĪŖ__£¬Ź½ÖŠxµÄŹżÖµ____”£
”¾“š°ø”æ0.8mol 80mL 13.6g 7.2NA aNA 80% 8.4 ![]() 0.02mol 6
0.02mol 6
”¾½āĪö”æ
¢Ł19.6æĖĮņĖįµÄĪļÖŹµÄĮæĪŖ![]() =0.2mol£¬ŗ¬ÓŠŃõŌ×ÓµÄĪļÖŹµÄĮæ=0.2mol ”Į4=0.8mol£¬½«ÕāŠ©ĮņĖįČÜÓŚĖ®Åä³É500mLČÜŅŗ£¬ĘäĮņĖįČÜŅŗµÄÅضČ=
=0.2mol£¬ŗ¬ÓŠŃõŌ×ÓµÄĪļÖŹµÄĮæ=0.2mol ”Į4=0.8mol£¬½«ÕāŠ©ĮņĖįČÜÓŚĖ®Åä³É500mLČÜŅŗ£¬ĘäĮņĖįČÜŅŗµÄÅضČ=![]() =0.4mol/L£¬“ÓĘäÖŠČ”³ö100mL£¬ĮņĖįµÄĪļÖŹµÄĮæ=0.4mol/L”Į0.1L=0.04mol£¬ĒāĄė×ÓµÄĪļÖŹµÄĮæ=0.04mol”Į2=0.08mol£¬øł¾ŻĖį¼īÖŠŗĶ·“Ó¦£ŗH++OH-=H2OæÉÖŖ0.08molµÄĒāĄė×ÓĻūŗÄĒāŃõøłĄė×Ó0.08mol£¬¼“æÉŅŌĻūŗĵÄNaOHČÜŅŗ0.08mol£¬ŌņĻūŗĵÄNaOHČÜŅŗµÄĢå»żĪŖ
=0.4mol/L£¬“ÓĘäÖŠČ”³ö100mL£¬ĮņĖįµÄĪļÖŹµÄĮæ=0.4mol/L”Į0.1L=0.04mol£¬ĒāĄė×ÓµÄĪļÖŹµÄĮæ=0.04mol”Į2=0.08mol£¬øł¾ŻĖį¼īÖŠŗĶ·“Ó¦£ŗH++OH-=H2OæÉÖŖ0.08molµÄĒāĄė×ÓĻūŗÄĒāŃõøłĄė×Ó0.08mol£¬¼“æÉŅŌĻūŗĵÄNaOHČÜŅŗ0.08mol£¬ŌņĻūŗĵÄNaOHČÜŅŗµÄĢå»żĪŖ![]() =80mL£»
=80mL£»
¢ŚH2O2Ėłŗ¬Ō×ÓŹżÓė0.2molH3PO4Ėłŗ¬Ō×ÓŹżĻąµČ£¬¼“¶žÕßĖłŗ¬Ō×ÓµÄĪļÖŹµÄĮæĻąµČ£»0.2molH3PO4ÖŠŗ¬ÓŠŌ×ÓµÄĪļÖŹµÄĮæ=0.2mol”Į£Ø3+1+4£©=1.6mol£¬ÉčĖ«ŃõĖ®µÄĪļÖŹµÄĮæĪŖnmol£¬Ōņnmol”Į£Ø2+2£©=1.6mol£¬½āµĆn=0.4£¬0.4mol H2O2µÄÖŹĮæ=0.4mol”Į34g/mol=13.6g£»Ņ»øöH2O2ÖŠŗ¬ÓŠ18øöÖŹ×Ó£¬0.4mol H2O2ÖŠĖłŗ¬ÖŹ×ÓŹżĪŖ0.4mol”Į18”ĮNA=7.2NA£»Ļą¶ŌŌ×ÓÖŹĮæŌŚŹżÖµÉĻµČӌĦ¶ūÖŹĮ棬1molĢśŗ¬ÓŠNAøöĢśŌ×Ó£¬ŌņNAøöĢśŌ×ÓµÄÖŹĮæ=NA”Įag= aNAg£¬¼“ĢśµÄĦ¶ūÖŹĮæĪŖaNAg/mol£¬ŌņĻą¶ŌŌ×ÓÖŹĮæaNA£»
¢ŪŌŚ±ź×¼×“æöĻĀ£¬1mol°±ĘųŗĶ¼×ĶéµÄ»ģŗĻĘųĢåµÄĢå»żĪŖ22.4L£¬Ōņ»ģŗĻĘųĢåµÄÖŹĮæĪŖ![]() =16.8g£¬Ōņ»ģŗĻĘųĢåµÄĦ¶ūÖŹĮæĪŖ16.8g/mol£¬ĄūÓĆŹ®×Ö½»²ę·Ø£ŗ
=16.8g£¬Ōņ»ģŗĻĘųĢåµÄĦ¶ūÖŹĮæĪŖ16.8g/mol£¬ĄūÓĆŹ®×Ö½»²ę·Ø£ŗ
 £¬Ōņ
£¬Ōņ![]() =
=![]() £¬ĻąĶ¬Ģõ¼žĻĀ£¬ĪļÖŹµÄĮæÖ®±ČµČÓŚĢå»żÖ®±Č£¬¼“
£¬ĻąĶ¬Ģõ¼žĻĀ£¬ĪļÖŹµÄĮæÖ®±ČµČÓŚĢå»żÖ®±Č£¬¼“![]() =
=![]() £¬Ōņ°±ĘųµÄĢå»ż·ÖŹżĪŖ
£¬Ōņ°±ĘųµÄĢå»ż·ÖŹżĪŖ![]() =80%£»ĻąĶ¬Ģõ¼žĻĀ£¬ĘųĢåµÄĦ¶ūÖŹĮæÖ®±ČµČÓŚĆܶČÖ®±Č£¬øĆ»ģŗĻĘųĢå¶ŌĒāĘųµÄĻą¶ŌĆܶČĪŖ
=80%£»ĻąĶ¬Ģõ¼žĻĀ£¬ĘųĢåµÄĦ¶ūÖŹĮæÖ®±ČµČÓŚĆܶČÖ®±Č£¬øĆ»ģŗĻĘųĢå¶ŌĒāĘųµÄĻą¶ŌĆܶČĪŖ![]() =8.4£»
=8.4£»
¢Üøł¾ŻĢāŅā£¬A”¢BĪŖ·“Ó¦Īļ£¬C”¢DĪŖÉś³ÉĪļ£¬»Æѧ·“Ó¦×ńŃÖŹĮæŹŲŗć£¬·“Ó¦ĪļµÄ×ÜÖŹĮæµČÓŚÉś³ÉĪļµÄ×ÜÖŹĮ棬ÉčÉś³ÉCµÄÖŹĮæĪŖmg£¬Ōņag+bg=m+dg£¬Ōņm=(a+b-d)g£¬ŌņCµÄĦ¶ūÖŹĮæ=![]() =
=![]() £»
£»
¢Ż½«MgCl2”¤xH2OµÄ¾§Ģå4.06gČÜÓŚĖ®Åä³É100mL MgCl2ČÜŅŗ£¬Č”³ö50mLČÜŅŗÕżŗĆÓė0.02moLµÄAgNO3ČÜŅŗĶźČ«×÷ÓĆ£¬Ąė×Ó·“Ó¦ĪŖCl-+Ag+= AgCl”ż£¬0.02moLµÄAgNO3ĶźČ«·“Ó¦ĻūŗÄMgCl20.01moL£¬Ōņ50mL MgCl2ČÜŅŗµÄÅضČĪŖ![]() £¬100mL MgCl2ČÜŅŗÖŠMgCl2µÄĪļÖŹµÄĮæ=0.2mol/L”Į0.1L=0.02mol£¬4.06gµÄMgCl2”¤xH2OĪļÖŹµÄĮæĪŖ0.02mol£»ÓÉn=
£¬100mL MgCl2ČÜŅŗÖŠMgCl2µÄĪļÖŹµÄĮæ=0.2mol/L”Į0.1L=0.02mol£¬4.06gµÄMgCl2”¤xH2OĪļÖŹµÄĮæĪŖ0.02mol£»ÓÉn=![]() =0.02mol£¬½āµĆx=6”£
=0.02mol£¬½āµĆx=6”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆĻņÉĻÅÅæÕĘų·ØŹÕ¼ÆŅ»ŹŌ¹ÜµÄĀČĘų£¬¾²ā¶ØĘäĆܶČĪŖĻąĶ¬Ģõ¼žĻĀĒāĘųĆÜ¶ČµÄ 26.5±¶”£½«øĆŹŌ¹Üµ¹Į¢ŌŚĖ®²ŪÖŠ£¬µ±ČÕ¹āÕÕÉäĻąµ±³¤Ņ»¶ĪŹ±¼äŗó£¬ŹŌ¹ÜÖŠ×īŗóŹ£ÓąµÄĘųĢåĢå»żŌ¼Õ¼ŹŌ¹ÜČŻ»żµÄ£Ø £©
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÄŚČŻÓė½įĀŪĻą¶ŌÓ¦µÄŹĒ
Ń”Ļī | ÄŚČŻ | ½įĀŪ |
A | H2O(g)±ä³ÉH2O(l) | ”÷S>0 |
B | ĻõĖįļ§ČÜÓŚĖ®æÉ×Ō·¢½ųŠŠ | ŅņĪŖ”÷S>0 |
C | Ņ»øö·“Ó¦µÄ”÷H>0£¬”÷S>0 | ·“Ó¦Ņ»¶Ø²»×Ō·¢½ųŠŠ |
D | H2(g)+F2(g)=2HF(g)£¬”÷H=-271kJ/mol ”÷S=8J/(mol”¤K) | ·“Ó¦ŌŚČĪŅāĶā½ēĢõ¼žĻĀ¾łæÉ×Ō·¢½ųŠŠ |
A. A B. B C. C D. D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĶ¼Ņ»±ķŹ¾µÄŹĒæÉÄę·“Ó¦CO(g)£«H2(g) ![]() C(s)£«H2O(g) ¦¤H£¾0µÄ»Æѧ·“Ó¦ĖŁĀŹ(v)ÓėŹ±¼ä(t)µÄ¹ŲĻµ£¬Ķ¼¶ž±ķŹ¾µÄŹĒæÉÄę·“Ó¦2NO2(g)
C(s)£«H2O(g) ¦¤H£¾0µÄ»Æѧ·“Ó¦ĖŁĀŹ(v)ÓėŹ±¼ä(t)µÄ¹ŲĻµ£¬Ķ¼¶ž±ķŹ¾µÄŹĒæÉÄę·“Ó¦2NO2(g) ![]() N2O4(g) ¦¤H£¼0µÄÅضČ(c)Ėꏱ¼ätµÄ±ä»ÆĒéæö”£ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
N2O4(g) ¦¤H£¼0µÄÅضČ(c)Ėꏱ¼ätµÄ±ä»ÆĒéæö”£ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ

A£®Ķ¼Ņ»t2Ź±øıäµÄĢõ¼žæÉÄÜŹĒÉżøßĮĖĪĀ¶Č»ņŹ¹ÓĆĮĖ“߻ƼĮ
B£®ČōĶ¼Ņ»t2Ź±øıäµÄĢõ¼žŹĒŌö“óŃ¹Ē棬Ōņ·“Ó¦µÄ¦¤HŌö“ó
C£®Ķ¼¶žt1Ź±øıäµÄĢõ¼žæÉÄÜŹĒÉżøßĮĖĪĀ¶Č»ņŌö“óĮĖŃ¹Ēæ
D£®ČōĶ¼¶žt1Ź±øıäµÄĢõ¼žŹĒŌö“óŃ¹Ē棬Ōņ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮ潫Ōö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©Ä³Ķ¬Ń§ÓĆĶŠÅĢĢģĘ½³ĘĮæÉÕ±µÄÖŹĮ棬ĢģĘ½Ę½ŗāŗóµÄדĢ¬ČēĶ¼”£ÓÉĶ¼ÖŠæÉŅŌ擳ö£¬øĆĶ¬Ń§ŌŚ²Ł×÷Ź±µÄŅ»øö“ķĪóŹĒ__£¬ÉÕ±µÄŹµ¼ŹÖŹĮæĪŖ__£Ø×īŠ”ķĄĀėĪŖ5g£©”£

£Ø2£©ŅŃÖŖij”°84”±Ļū¶¾ŅŗĘæĢå²æ·Ö±źĒ©ČēĶ¼ĖłŹ¾£¬øĆ”°84”±Ļū¶¾ŅŗĶس£Ļ”ŹĶ100±¶(Ģå»żÖ®±Č)ŗóŹ¹ÓĆ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
ÓŠŠ§³É·Ö | NaClO |
¹ęøń | 1000mL |
ÖŹĮæ·ÖŹż | 25% |
ĆÜ¶Č | 1.19g”¤cm-1 |
¢ŁøĆ”°84”±Ļū¶¾ŅŗĪļÖŹµÄĮæÅضČŌ¼____ mol”¤L-1(±£ĮōŅ»Ī»Š”Źż)”£
¢ŚÄ³Ķ¬Ń§Č”20mLøĆ”°84”±Ļū¶¾Ņŗ£¬Ļ”ŹĶŗóÓĆÓŚĻū¶¾£¬Ļ”ŹĶŗóµÄČÜŅŗÖŠc(Na+)=__mol”¤L-1”£
¢Ū”°84”±Ļū¶¾ŅŗÓėĻ”ĮņĖį»ģŗĻŹ¹ÓĆæÉŌöĒæĻū¶¾ÄÜĮ¦£¬Ä³Ļū¶¾Š”×éČĖŌ±ÓĆÅØĮņĖįÅäÖĘĻ”ĮņĖįÓĆÓŚŌöĒæ”°84”±Ļū¶¾ŅŗµÄĻū¶¾ÄÜĮ¦£¬ĻĀĮŠ²Ł×÷Ź¹ĖłÅäÖʵÄĮņĖįČÜŅŗÅضČĘ«µĶµÄŹĒ__”£
a£®ĮæČ”ÅØĮņĖįŹ±£¬ø©ŹÓĮæĶ²æĢ¶ČĻß b£®Ī“¾ĄäČ“¾Ķ½«ČÜŅŗ×ŖŅĘÖĮČŻĮæĘæ
c£®ČÜŅŗ¶ØČŻŅ”ŌČŗó£¬ÓŠÉŁĮæĮ÷³ö d£®Ć»ÓŠĻ“µÓĮæČ”ÅØĮņĖįµÄĮæĶ²
e£®¶ØČŻŹ±ŃöŹÓČŻĮæĘææĢ¶ČĻß f£®ČŻĮæĘæÄŚ²ŠĮōŅ»¶ØĮæÕōĮóĖ®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆŗĻĪļH(![]() )£¬ŹĒŅ»ÖÖ³£¼ūµÄæ¹½į³¦Ń×Ņ©Īļ”£ČēĶ¼ŹĒĄūÓĆ·¼ĻćĢžAĪŖŌĮĻÉč¼ĘÖʱøHµÄĀ·Ļß”£
)£¬ŹĒŅ»ÖÖ³£¼ūµÄæ¹½į³¦Ń×Ņ©Īļ”£ČēĶ¼ŹĒĄūÓĆ·¼ĻćĢžAĪŖŌĮĻÉč¼ĘÖʱøHµÄĀ·Ļß”£

ŅŃÖŖ£ŗ¢ŁAÕōĘųµÄĆܶȏĒĻąĶ¬Ģõ¼žĻĀĒāĘųĆܶȵÄ46±¶£»
¢Ś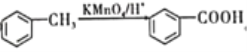 ”£
ӣ
»Ų“šĻĀĮŠĪŹĢā
£Ø1£©AµÄĆū³ĘŹĒ_______£¬CÖŠŗ¬ÓŠ¹ŁÄÜĶŵÄĆū³ĘŹĒ____”£
£Ø2£©Š“³öCÉś³ÉDµÄ»Æѧ·½³ĢŹ½£ŗ______£¬øĆ·“Ó¦µÄĄąŠĶŹĒ______”£
£Ø3£©GµÄ½į¹¹¼ņŹ½ŹĒ______”£
£Ø4£©Éč¼ĘC”śDŗĶE”śFĮ½²½·“Ó¦µÄÄæµÄŹĒ______”£
£Ø5£©»ÆŗĻĪļXŹĒDµÄĶ¬·ÖŅģ¹¹Ģ壬·ūŗĻĻĀĮŠĢõ¼žµÄX¹²______ÖÖ”£
¢Ł·¼Ļć×å»ÆŗĻĪļ£¬ĒŅ±½»·ÉĻÓŠĮ½øöČ”“ś»ł¢ŚÄÜ·¢ÉśĖ®½ā·“Ó¦
Š“³öĘäÖŠŗĖ“Ź²ÕńĒāĘ×ĻŌŹ¾ÓŠ4ÖÖ²»Ķ¬»Æѧ»·¾³µÄĒāŌ×Ó£¬·åĆ껿֮±ČĪŖ3£ŗ3£ŗ2£ŗ2µÄĖłÓŠXµÄ½į¹¹¼ņŹ½£ŗ______”£
£Ø6£©ŅŃÖŖ![]() Ņ×±»Ńõ»Æ£¬±½»·ÉĻĮ¬ÓŠĶ黳Ź±ŌŁŅżČėŅ»øöČ”“ś»ł£¬³£Č”“śŌŚĶ黳µÄĮŚ”¢¶ŌĪ»£¬¶ųµ±±½»·ÉĻĮ¬ÓŠōČ»łŹ±ŌņČ”“śŌŚ¼äĪ»”£¾Ż“ĖŠ“³öŅŌAĪŖŌĮĻÖʱø»ÆŗĻĪļ
Ņ×±»Ńõ»Æ£¬±½»·ÉĻĮ¬ÓŠĶ黳Ź±ŌŁŅżČėŅ»øöČ”“ś»ł£¬³£Č”“śŌŚĶ黳µÄĮŚ”¢¶ŌĪ»£¬¶ųµ±±½»·ÉĻĮ¬ÓŠōČ»łŹ±ŌņČ”“śŌŚ¼äĪ»”£¾Ż“ĖŠ“³öŅŌAĪŖŌĮĻÖʱø»ÆŗĻĪļ![]() µÄŗĻ³ÉĀ·Ļß(ĪŽ»śŹŌ¼ĮČĪŃ”)___________”£
µÄŗĻ³ÉĀ·Ļß(ĪŽ»śŹŌ¼ĮČĪŃ”)___________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĢõ¼žĻĀ£¬¶ŌÓŚæÉÄę·“Ó¦X(g)+3Y(g)![]() 2Z(g)£¬ČōX”¢Y”¢ZµÄĘšŹ¼ÅØ¶Č·Ö±šĪŖc1”¢c2”¢c3(¾ł²»ĪŖĮć)£¬“ļĘ½ŗāŹ±£¬X”¢Y”¢ZµÄÅØ¶Č·Ö±šĪŖ0.1 mol/L”¢0.3 mol/L”¢0.08 mol/L£¬ŌņĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ (”” ””)
2Z(g)£¬ČōX”¢Y”¢ZµÄĘšŹ¼ÅØ¶Č·Ö±šĪŖc1”¢c2”¢c3(¾ł²»ĪŖĮć)£¬“ļĘ½ŗāŹ±£¬X”¢Y”¢ZµÄÅØ¶Č·Ö±šĪŖ0.1 mol/L”¢0.3 mol/L”¢0.08 mol/L£¬ŌņĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ (”” ””)
A. c1£ŗc2£½3”Ć1 B. Ę½ŗāŹ±£¬YŗĶZµÄÉś³ÉĖŁĀŹÖ®±ČĪŖ2”Ć3
C. X”¢YµÄ×Ŗ»ÆĀŹ²»ĻąµČ D. c1µÄȔֵ·¶Ī§ĪŖ0 mol/L<c1 <0.14 mol/L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±½ŅŅĻ©ŹĒÉś²śĖÜĮĻŗĶŗĻ³ÉĻš½ŗµÄÖŲŅŖ»ł±¾ÓŠ»śŌĮĻ£¬ŅŅ±½“ß»ÆĶŃĒā·ØŹĒÄæĒ°¹śÄŚĶāÉś²ś±½ŅŅĻ©µÄÖ÷ŅŖ·½·Ø£¬Ęä»Æѧ·½³ĢŹ½ĪŖ£ŗ
![]()
£Ø1£©ČōÉżøßĪĀ¶Č£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż±ä“ó£¬Ōņ¦¤H_______0£ØĢī”°“óÓŚ”±»ņ”°Š”ÓŚ”±£©”£øĆ·“Ó¦ŌŚ_______________Ģõ¼žĻĀÄÜ×Ō·¢½ųŠŠ”£
£Ø2£©Ī¬³ÖĢåĻµ×ÜŃ¹Ēæ¦Ńŗć¶Ø£¬ŌŚĪĀ¶ČTŹ±£¬ĪļÖŹµÄĮæĪŖ2mol”¢Ģå»żĪŖ1LµÄŅŅ±½ÕōĘū·¢Éś“ß»ÆĶŃĒā·“Ó¦”£ŅŃÖŖŅŅ±½µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ80%£¬ŌņŌŚøĆĪĀ¶ČĻĀ·“Ó¦µÄĘ½ŗā³£ŹżK=_____”£
£Ø3£©ŌŚĢå»żĪŖ2LµÄŗćĪĀĆܱÕČŻĘ÷ÖŠĶØČė2molŅŅ±½ÕōĘū£¬2·ÖÖÓŗó“ļµ½Ę½ŗā£¬²āµĆĒāĘųµÄÅØ¶ČŹĒ0.5mol/L£¬ŌņŅŅ±½ÕōĘūµÄ·“Ó¦ĖŁĀŹĪŖ_________________£»Ī¬³ÖĪĀ¶ČŗĶČŻĘ÷Ģå»ż²»±ä£¬ĻņÉĻŹöĘ½ŗāÖŠŌŁĶØČė1molĒāĘųŗĶ1molŅŅ±½ÕōĘū£¬ŌņvÕż_______vÄę£ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ¹ŲĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾(²æ·ÖĪļÖŹÓėĢõ¼žŅŃĀŌČ„)”£A”¢B”¢C”¢D”¢F¾łĪŖĘųĢ壬ĘäÖŠAµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ16£¬FŹĒ»ĘĀĢÉ«µ„ÖŹ£»EŹĒ×ī³£¼ūµÄŅŗĢ壻XĪ¢ČÜÓŚĖ®£¬·“Ó¦¢ŁŹĒ¹¤ŅµÉś²śÖŠµÄÖŲŅŖ·“Ó¦£¬·“Ó¦¢Ś³£ÓĆÓŚDµÄ¼ģŃ锣

Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)AµÄµē×ÓŹ½ĪŖ______”£
(2)CµÄ»ÆѧŹ½ĪŖ______”£
(3)Š“³ö·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½£ŗ________________”£
(4)Š“³ö·“Ó¦¢ŚµÄĄė×Ó·½³ĢŹ½£ŗ________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com