
某溶液中存在XO-,且X为短周期元素,则一定能在该溶液中大量共存的离子组是
A.Na+、H+、SO 、I- B.Na+、Ca2+、CO
、I- B.Na+、Ca2+、CO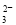 、Al3+
、Al3+
C.Na+、K+、Fe2+、H+ D.K+、SO 、Cl-、CO
、Cl-、CO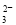
 考前必练系列答案
考前必练系列答案科目:高中化学 来源:2015届河北省唐山市高三10月月考理综化学试卷(解析版) 题型:实验题
(15分)银氨溶液可用于检测CO气体,实验室研究的装置如图:
| 已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:选择题
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是( )
A.若M(甲)>M(乙),则气体体积:甲<乙
B.若M(甲)<M(乙),则气体的压强:甲>乙
C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙
D.若M(甲)<M(乙),则的分子数:甲<乙
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第二次月考化学试卷(解析版) 题型:选择题
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示。

则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1∶1∶1 B.1∶3∶1 C.3∶3∶8 D.1∶1∶4
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第二次月考化学试卷(解析版) 题型:选择题
关于胶体的认识以及应用不正确的是
A.鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于物理变化
B.纳米材料微粒直径一般从几纳米到几十纳米(1 nm= 10?9 m).因此纳米材料属于胶体
C.往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解
D.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高三第二次模拟考试化学试卷(解析版) 题型:填空题
(10分)实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下:

请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式: 。
(2)将过程②中产生的气体通入下列溶液中,溶液会腿色的是 。
A.品红溶液 B.紫色石蕊试液 C.酸性高锰酸钾溶液 D.溴水
(3)过程③中,需要加入的物质是 (化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有 。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高三第二次模拟考试化学试卷(解析版) 题型:选择题
以下示意图与相对应的反应情况分析正确的是

A.图1 :向含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2
B.图2 :向NaHSO4溶液中逐滴加入Ba(OH)2溶液
C.图3 :向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D.图4 :向NaAlO2溶液中逐滴加入盐酸
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(6分) (1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中,还原剂是________。
(2)已知BrFx与H2O按物质的量之比3∶5反应的产物是HF、HBrO3、Br2、O2,该反应中的氧化剂是________,还原剂是________,BrFx中的x=________。
(3)浓盐酸在反应KClO3+HCl―→KCl+ClO2+Cl2+( ) (补充完整此项化学式及化学计量数)中显示出来的性质是_ 。
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为________________。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第一次模拟考试化学试卷(解析版) 题型:实验题
(8分)胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO4?5H2O。在加热情况下,按温度不同,胆矾晶体会历经一系列的变化,得到不同组成的固体。(第(1)(2)问用小数表示)
(1)称取0.10g含有杂质的胆矾试样于锥形瓶中,加入0.10 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.10 mol/L硫酸滴定到终点,消耗硫酸10.08 mL,则试样中胆矾的质量分数为________(已知:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4;试样中杂质不与酸碱反应)
(2)将1.250 g 纯净的胆矾晶体置于坩埚中加热一段时间,测得剩余固体质量为0.960 g。剩余固体中结晶水的质量分数为__________(保留三位小数)。
(3)将无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体。现将9.600 g无水硫酸铜充分加热分解为氧化铜,将生成的气体通过足量的吸收剂(碱石灰),吸收剂增重4.416 g。则最终吸收剂中硫酸盐与亚硫酸盐的物质的量之比为
(4)取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com