
【题目】下列解释事实的方程式正确的是( )
A. 用碳酸钠治疗胃酸过多![]()
B. 用氨水吸收烟气中的二氧化硫![]()
C. 把金属钠放入冷水中产生气体![]()
D. 用氢氧化钠溶液可以溶解氢氧化铝固体![]()
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】I.在现代有机化工生产中,通过天然气裂解所得某种主要成分,已成为制造合成纤维、人造橡胶、塑料的基石.其中相关物质间的转化关系如下图所示(C、G是两种常见的塑料,E的结构简式为![]() )
)
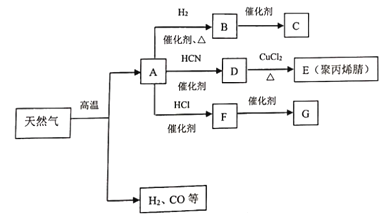
请回答下列问题:
(1)写出B的电子式_________。
(2)分别写出下列反应的化学方程式A→D______;F→G______。
II.为测定某有机化合物X的化学式. 进行如下实验;将0.15mo1有机物B和0.45mol O2在密闭容器中完全燃烧后的产物为CO2、CO、H2O(气),产物经过浓H2SO4后.质量增加8.1g,再通过灼热的氧化铜充分反应后,质量减轻2.4g,最后气体再通过碱石灰被完全吸收,质量增加19.8g. 试通过计算确定该有机物X的化学式(写出计算过程) _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )
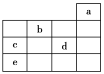
A. 元素b位于第ⅥA族,有+6、-2价两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c>d
D. 元素c和e的气态氢化物的稳定性:c>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. 分子式为C8H8O2的芳香族化合物中属于羧酸的同分异构体有3种
B. 麦芽糖的水解产物有两种,且互为同分异构体
C. 等质量的苯和苯乙烯(![]() )完全燃烧,消耗氧气的体积相同
)完全燃烧,消耗氧气的体积相同
D. 分子式为C4H8Cl2且含有两个甲基的有机物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)反应I2+2S2O32-===2I-+S4O62-常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1 mL淀粉溶液作指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择____(填序号)。
①1 mL 0.01 mol·L-1的碘水 ②1mL0.001 mol·L-1的碘水
③4 mL 0.01 mol·L-1的Na2S2O3溶液 ④4mL0.001 mol·L-1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32-)=_____。
Ⅱ.一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g),下列能说明反应达到平衡状态的是___。
SO3(g)+NO(g),下列能说明反应达到平衡状态的是___。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO2的物质的量之比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
Ⅲ.已知2NO2(g)![]() N2O4(g) ΔH<0。现将NO2和N2O4的混合气体通入恒温恒容为2升的密闭容器中,反应体系中物质浓度随时间的变化关系如图所示。
N2O4(g) ΔH<0。现将NO2和N2O4的混合气体通入恒温恒容为2升的密闭容器中,反应体系中物质浓度随时间的变化关系如图所示。
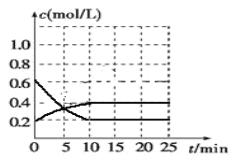
①平衡时NO2的转化率____;②起始压强与平衡时压强之比____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J mol-1·K-1,该反应能自发进行的温度范围为____________________。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J mol-1·K-1,该反应能自发进行的温度范围为____________________。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
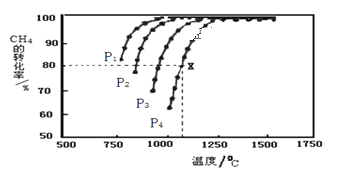
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因__________________________。
②在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为________________,该温度下,反应的平衡常数为_____________________(保留3位有效数字)。
(3) CO和H2在工业上还可以通过反应C(s)+H2O(g) ![]() CO(g)+H2 (g)来制取,在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是________________________。
CO(g)+H2 (g)来制取,在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是________________________。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.气体平均相对分子质量保持不变
(4) 甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1mol·L -1食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
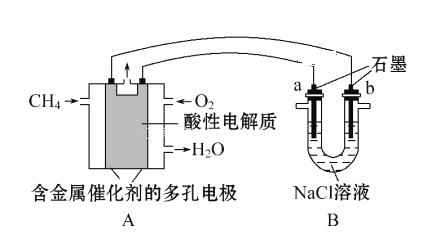
①甲烷燃料电池的负极反应式: _____________________________________________
②电解后溶液的pH= __________________________(忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下是 __________________L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E 元素的周期序数与主族序数相等。
(1)E 元素在周期表中的位置___________。
(2)写出A2W2的电子式为____________。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________。
(4)元素D的单质在一定条件下,能与 A 单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE 单质混合加入足量的水,充分反应后成气体的体积是_________(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com