
(14分)A、B、C、D、E五种短周期元素。A元素所处的周期数、主族序数、原子序数均相等;B元素原子的半径是其所在主族中最小的,其最高价氧化物对应水化物的化学式为HBO3;C元素原子最外层上的电子数为内层电子数的2倍;元素D的二价阴离子与E的阳离子的核外电子排布相同;E元素的周期数比族序数多2。请回答:
(1) 写出元素的符号:A ;B_______。
(2) 画出D离子的结构示意图__________,C在周期表的位置为 ;
(3) C的最高价氧化物的电子式是 ;E与D的单质在常温下反应的生成物电子式为 ,E与D按原子数1∶1化合而成的物质所含化学键类型为 。
(4) A与D可形成三种电子总数为10的微粒,其中形成的分子结构式为 ,写出另二种微粒其中一种的化学式 ; A与D还可形成电子总数为18的微粒,该微粒的化学式为 。
(1) H;N(2分) (2)
 ,第二周期第ⅣA族;(1+2分)
,第二周期第ⅣA族;(1+2分)
(3) 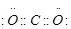 (2分);
(2分);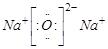 (2分);离子键、共价键(2分)。
(2分);离子键、共价键(2分)。
(4)H—O—H;OH—或H3O+;H2O2(1+1+2分)
【解析】考查元素周期表的结构。元素周期律的应用及核外电子的排布规律等。A元素所处的周期数、主族序数、原子序数均相等,则A是氢元素。最高价氧化物对应水化物的化学式为HBO3,则B是第ⅤA,因此B是N。C元素原子最外层上的电子数为内层电子数的2倍,则C是C元素。元素D的二价阴离子与E的阳离子的核外电子排布相同,说明D是第二周期,E是第三周期。又因为E元素的周期数比族序数多2,所以E是钠,则D是O。


科目:高中化学 来源: 题型:
容器温度 浓度 |
a容器 400℃ |
b容器 425℃ |
c容器 450℃ |
d容器 475℃ |
e容器 500℃ |
| c(O2) | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
| c(SO3) | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |

| c2(SO3) |
| c2(SO2)×c(O2) |
| c2(SO3) |
| c2(SO2)×c(O2) |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



| ①O3 | ②Zn,H2O |




查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com