
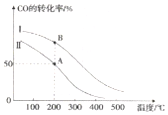
 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:分析 I.根据热化学方程式利用盖斯定律计算反应热并书写热化学方程式;
II.(1)分析图象可知,一氧化碳转化率随温度升高减小,说明平衡逆向进行分析反应能量变化;
(2)①依据相同温度下一氧化碳的转化率变化分析投料比;
②结合投料比较少氢气物质的量,依据化学平衡三段式列式计算平衡浓度,得到A点的平衡常数,AB是相同温度下的平衡,平衡常数只随温度变化分析;
(3)为提高CO转化率,可以增加氢气量,提高一氧化碳的转化率,反应是放热反应,降低温度平衡正向进行,依据反应特征和平衡移动原理分析提高一氧化碳转化率的条件是平衡正向进行.
解答 解:I.(1)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
根据盖斯定律,将已知反应$\frac{1}{2}$×(①-②+③×4)得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=$\frac{1}{2}$×[(-1275.6kJ/mol)-(-566.0kJ/mol)+(-44.0kJ/mol)×4]=-442.8kJ•mol-1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
II.(1)图象可知,一氧化碳转化率随温度升高减小,说明平衡逆向,正反应为放热反应,a<0,
故答案为:<;升高温度,CO的转化率降低,平衡左移,正反应为放热反应;
(2)①相同温度下一氧化碳的转化率变化分析投料比,Ⅰ和Ⅱ相比,Ⅰ的一氧化碳转化率大于Ⅱ的转化率,说明反应物投料比$\frac{c(CO)_{起始}}{c({H}_{2})_{起始}}$),Ⅰ<Ⅱ;
故答案为:<;
②若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,n(H2)=20mol,依据化学平衡三段式列式计算
CO(g)+2H2(g)═CH3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.5 1 0.5
平衡量(mol/L) 0.5 1 0.5
A点的平衡常数KA =$\frac{0.5}{0.5×{1}^{2}}$=1
AB是相同温度下的平衡,平衡常数只随温度变化,所以AB平衡常数相同;
故答案为:1;1;
(3)为提高CO转化率可采取的措施,可以增加氢气量,提高一氧化碳的转化率,反应是放热反应,降低温度平衡正向进行,依据反应特征和平衡移动原理分析提高一氧化碳转化率的条件是平衡正向进行,即减小投料比、较低温度、增大压强、分离出CH3OH,
故答案为:较低温度、增大压强.
点评 本题考查了化学平衡、平衡常数,反应速率影响因素分析判断,化学平衡计算,化学平衡的建立过程分析应用,掌握基础是关键,题目难度中等.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,在$\frac{c(H+)}{c(OH-)}$=1012的溶液中,Fe2+、I-、NO3-、Cl-一定不能大量共存 | |
| B. | H2A是二元弱酸,常温下,0.1mol/LNaHA溶液的pH约为5,说明HA-电离程度大于水解程度 | |
| C. | 使用催化剂一定能够降低化学反应的反应热(△H) | |
| D. | NA为阿伏加德罗常数的值,常温常压下,28gC2H4和C3H6混合气体含有的原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解为乙烯属于取代反应 | |
| B. | 乙酸分子中含有碳氧双键,所以它能使溴水褪色 | |
| C. | 蛋白质在一定条件下发生水解反应生成葡萄糖 | |
| D. | C4H10进行一氯取代后生成四种沸点不同的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| M | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| N | 原子的M电子层上有3个电子 |
| W | 在短周期元素中,其原子半径最大 |
| X | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成X的单质和H2O |
| Y | 元素最高价正价与最低负价的代数和为6 |
| A. | M的气态氢化物具有还原性,常温下,该氢化物水溶液的pH>7 | |
| B. | W单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 由N和Y所形成的化合物中存在离子键,属于离子化合物 | |
| D. | N、W、X的最高价氧化物对应的水化物两两之间能相互发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④ | C. | ①②⑤ | D. | ②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com