
| A. | 10种 | B. | 9种 | C. | 8种 | D. | 7种 |
分析 有机物X的蒸气相对氢气的密度为51,则X的相对分子质量为51×2=102,X中氧元素的质量分数为31.7%,则分子中N(O)=$\frac{102×31.7%}{16}$=2,分子中碳、氢元素的原子量之和为102-16×2=70,利用余商法$\frac{70}{14}$=5…0,所以分子式为C5H10O2,能在碱性溶液中发生反应且生成两种有机物,则有机物X属于酯,从而判断同分异构体.
解答 解:有机物X的蒸气相对氢气的密度为51,则X的相对分子质量为51×2=102,X中氧元素的质量分数为31.7%,则分子中N(O)=$\frac{102×31.7%}{16}$=2,分子中碳、氢元素的原子量之和为102-16×2=70,利用余商法$\frac{70}{14}$=5…0,所以分子式为C5H10O2,分子式为C5H10O2的有机物能在碱性溶液中发生反应且生成两种有机物,则有机物X属于酯,
若为甲酸和丁醇酯化,丁醇有4种,可形成4种酯;
若为乙酸和丙醇酯化,丙醇有2种,可形成2种酯;
若为丙酸和乙醇酯化,丙酸有1种,可形成1种酯;
若为丁酸和甲醇酯化,丁酸有2种,可形成2种酯;
所以共有9种酯;
故选B.
点评 本题考查有机物分子式的确定、同分异构体书写、官能团的性质等,计算确定有机物的分子式、确定酯的种类是解题的关键,注意掌握官能团的性质.


科目:高中化学 来源: 题型:解答题
 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
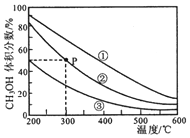
| A. | 该反应的正反应为放热反应 | |
| B. | 三个容器容积:①>②>③ | |
| C. | 在P点,CO转化率为75% | |
| D. | 在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n(CO)/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
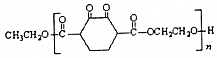 )是人造棉的主要成分之一,合成线路如图:
)是人造棉的主要成分之一,合成线路如图: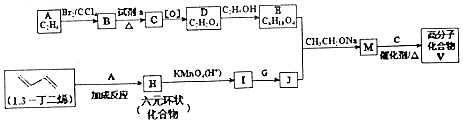
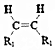 $\stackrel{KMnO_{4}/H+}{→}$2R1COOH
$\stackrel{KMnO_{4}/H+}{→}$2R1COOH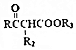 +R1OH
+R1OH CH3CH2OOC-COOCH2CH3+2H2O.
CH3CH2OOC-COOCH2CH3+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 负极的电极反应式为Mg+2OH-+2e-═Mg(OH)2 | |
| B. | 电池放电时,OH-向负极移动 | |
| C. | 电解质溶液可以是稀H2SO4 | |
| D. | 正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,78g苯的碳碳双键数目为3NA | |
| B. | 1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价健数均为4NA | |
| C. | 500mL2mol/LNH4NO3溶液中,含有氮原子数目为2NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子数效目一定为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com