

 B.
B. C.泡利原理 D.洪特规则
C.泡利原理 D.洪特规则分析 如图为元素周期表前三周期的一部分,由元素在周期表的位置可知,R为Ar,X为N,W为P,Y为S,Z为F,
(1)分子的相对分子质量越大,分子间作用力越大,氢化物的沸点越高;
(2)X的基态原子的最外层有5个电子,由洪特规则可知3p电子优先占据一个轨道;
(3)元素原子失去核外第一个电子需要的能量为第一电离能,非金属性越强,第一电离能越弱.
解答 解:如图为元素周期表前三周期的一部分,由元素在周期表的位置可知,R为Ar,X为N,W为P,Y为S,Z为F,
(1)X、W的氢化物分别为NH3、PH3,NH3分子间易形成氢键,分子间作用力大,氢化物的沸点高,故氢化物的沸点大小顺序为PH3<NH3;
故答案为:NH3;NH3分子间易形成氢键;
(2)X为N元素,N的基态原子的最外层有5个电子,由洪特规则可知3p电子优先占据一个轨道,X的基态原子的最外层原子轨道表示式为 ,另一原子轨道表示式违反了洪特规则,
,另一原子轨道表示式违反了洪特规则,
故答案为:B;D;
(3)R为Ar,W为P,Y为S,原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关,结构越稳定失电子所需能量越高,R元素已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多;P的非金属性较强,其失去电子能力越弱,失去核外第一个电子需要能量越大,则原子失去核外第一个电子需要能量由多到少的顺序为:Ar>P>S,
故答案为:Ar>P>S.
点评 本题考查位置、结构与性质关系的应用,为高频考点,把握元素的位置、元素的性质及原子结构为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:推断题
| A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
| 含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
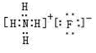 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷的一溴代物有4种 | |
| B. | 乙烯和聚氯乙烯都能使溴水褪色 | |
| C. | 乙醇、乙酸既可用NaOH区分,也可以用小苏打区分 | |
| D. | 乙酸乙酯既能发生加成反应又能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中 c(K+)为 2 mol•L-1 | |
| B. | 电解过程中共转移 8 mol电子 | |
| C. | 电解得到的Cu 的物质的量为 0.5 mol | |
| D. | 电解后溶液中的 c(H+)为 2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn ),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是 222 | |
| B. | Se 是人体必需的微量元素,${\;}_{34}^{78}$Se 和${\;}_{34}^{80}$Se 互为同位素 | |
| C. | ${\;}_{92}^{235}$U 的浓缩一直被国际社会关注,${\;}_{92}^{235}$U 与 ${\;}_{92}^{238}$U 是两种不同的核素 | |
| D. | ${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析,${\;}_{6}^{13}$C 的中子数为 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生装置与用KClO3制取O2的装置相同 | |
| B. | 可用浓硫酸干燥氨气 | |
| C. | 可用向下排空气法收集氨气 | |
| D. | 氨气的验满可以用蘸有浓盐酸的玻璃棒放于试管口附近 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳棒作电极电解饱和食盐水,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| B. | 由C(石墨)(s)═C(金刚石)(s)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 粗铜精炼时,与电池正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com