
| A. | 量筒 | B. | 碱式滴定管 | C. | 酸式滴定管 | D. | 容量瓶 |
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的状态与反应热有关 | B. | 物质的状态与生成物有关 | ||
| C. | 可以具体说明反应进行的情况 | D. | 可以具体说明反应发生的条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
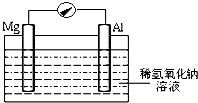 近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展.
近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一种核素 | B. | 互为同分异构体 | C. | 互为同素异形体 | D. | 互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
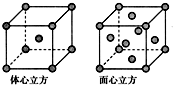 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:3 | C. | 3:2 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com