
在2A+B  3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) =" 0.3" mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)=" 1" mol·L-1·S-1
B
解析试题分析:同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比是相应的化学计量数之比先换算成用同一种物质表示,然后才能直接比较速率数值。所以根据反应的方程式可知,如果都要物质C表示反应速率,则分别是0.75 mol/(L·s)、0.9mol/(L·s)、0.8 mol/(L·s)、0.75mol/(L·s),所以答案选B。
考点:考查反应速率快慢的判断
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题还需要注意的是在进行反应速率的转换时,还要注意单位的统一。


科目:高中化学 来源: 题型:单选题
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl 的浓度。影响反应速率的因素是
的浓度。影响反应速率的因素是 
| A.①④ | B.③④ |
| C.①②③ | D.②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
过量的铁粉与100 mL 0.1 mol/L的稀盐酸反应,反应速率太快。为了降低此反应速率而不改变产生H2的量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入过量浓硫酸 ④加少量的CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 1 mol/L的盐酸
| A.①⑥⑦ | B.①④⑤ | C.③⑦⑧ | D.③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是 ( )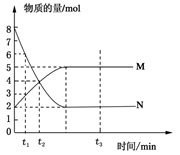
| A.t2时M与N的物质的量浓度之比为1:1 |
| B.t2与t3时刻的混合气体的平均相对分子质量相等 |
| C.反应物与生成物平衡时的物质的量浓度之比是2:5 |
D.0~t2内用M表示的平均反应速率是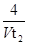 mol/(L?min) mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一个真空固定体积的密闭容器内,充入10molN2和30molH2,发生合成氨反应:N2+3H2 2NH3,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成份的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是( )
2NH3,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成份的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是( )
| A.15mol 25% | B.20mol 50% | C.20mol 75% | D.40mol 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用某工厂的废渣(主要含CuO70%、MgFe2O420%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红。流程如图所示。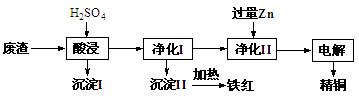
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式: 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
。
(2)用净化II所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:______________________________。
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/LKMnO4溶液装入
(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL。(反应离子方程式:5Fe2++MnO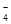 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(2分)某温度时,在2L固定体积的密闭容器中X、Y、Z三种气体随时间的变化如图所示: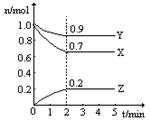
(1)该反应的化学方程式为 ;
(2)下列表示该反应速率最大的是
A.v(X)=0.6mol/(L·s) B.v(Y)=0.3mol/(L·s) C.v(Z)=0.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源。目前分解水制氢气的工业制法之一是“硫—碘循环”,主要涉及下列反应:
Ⅰ SO2+2H2O+I2= H2SO4+2HI Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4= 2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0—2min内的平均反应速率v(HI)= 。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
H2(g)+I2(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)SO2在一定条件下可被氧化生成SO3,其反应为:2SO2 (g) + O2(g)  2SO3(g) △H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
2SO3(g) △H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。 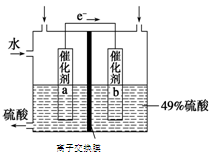
①a电极的电极反应式为 ;
②若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为 。
(4)实际生产还可以用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入10 mol/L的硫酸溶液的体积范围为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com