
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
A.A
B.B
C.C
D.D
【答案】A
【解析】解:该反应为正方向体积增加且吸热.A、升高温度,平衡正向移动,气体的质量增加,密度增大,故A正确;
B、增加CO的量,平衡正向移动,但压强增大,CO的转化率,没有上一平衡多,故比值减小,故B错误;
C、平衡常数只与温度有关,浓度变化平衡常数不变,故C错误;
D、因MgSO4为固体,增加其量,对CO的转化率无影响,故D错误;
故选A.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】肼( ![]() )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:
(2)已知:①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJmol﹣1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJmol﹣1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:
(3)已知断裂1mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N﹣N为154、H﹣O为464、请根据N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJmol﹣1中数据计算断裂1molN﹣H键所需的能量(kJ)是:
(4)写出NH3与NaClO反应得到肼的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),以下是不同情况下的反应速率,其中最快的是( )
A.v(O2)=0.01 molL﹣1s﹣1
B.v(NH3)=0.02molL﹣1s﹣1
C.v(H2O)=0.06 molL﹣1min﹣1
D.v(NO)=0.03molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 甲烷可以使酸性高锰酸钾溶液褪色
B. 甲烷与氯气发生的反应属于取代反应
C. 甲烷与Cl2反应的生成物只有一氯甲烷和氯化氢
D. 甲烷分子的构型为平面四边形,C—H键的长度和夹角完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向aL密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(s)+2Y(g)2Z(g),能判断该反应达平衡状态的是( )
A.容器内气体压强不随时间变化
B.容器内气体密度不随时间变化
C.容器内X,Y,Z的浓度之比为1:2:2
D.X的消耗速率和Z的生成速率之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.由KClO3变成KCl必须加入还原剂
B.向醋酸溶液中加入少量氢氧化钠溶液,因发生中和反应,溶液的导电能力降低
C.已知氨水的密度比水小,且浓度越大密度越小.则质量分数分别为5%和15%的氨水等体积混合,得到的溶液的质量分数大于10%
D.一定条件下,H2与O2的混合气体对氮气的相对密度为1,则H2与O2的物质的量之比为2:13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:
(1)Cr3+与Al3+的化学性质相似,往Cr2(SO4)3溶液中滴入NaOH溶液直至过量,可观察到的现象是 .
(2)CrO42﹣和Cr2O72﹣在溶液中可相互转化.室温下,初始浓度为1.0molL﹣1的Na2CrO4溶液中c(Cr2O72﹣)随c(H+)的变化如图所示. 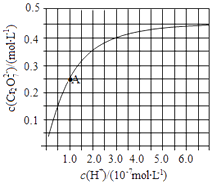
①用离子方程式表示Na2CrO4溶液中的转化反应 .
②由图可知,溶液酸性增强,CrO42﹣的平衡转化率(填“增大“减小”或“不变”).
根据A点数据,计算出该转化反应的平衡常数为 .
(3)用K2CrO4为指示剂,以AgNO3标准液滴定溶液中的Cl﹣ , Ag+与CrO42﹣生成砖红色沉淀时到达滴定终点.当溶液中Cl﹣恰好完全沉淀(浓度等于1.0×10﹣5molL﹣1)时,溶液中c (Ag+)为molL﹣1 , 此时溶液中c(CrO42﹣)等于molL﹣1 . (Ksp(Ag2CrO4)=2.0×10﹣12、Ksp(AgCl)=2.0×10﹣10).
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72﹣还原成Cr3+ , 反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分子中既有σ键,又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2 .
A.①②③
B.③④⑤⑥
C.①③⑥
D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.1molCH4与4molCl2在光照下完全反应可生成1molCCl4
B.甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应
C.乙烯能被酸性高锰酸钾溶液氧化,而苯不易
D.1体积的C2H4完全燃烧需同温同压下3体积的O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com