
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
B、在
| ||
| C、在0.1 mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
| D、在0.1 mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
| A、2.0g超重水(3H2O)中含有的质子数为1.0 NA |
| B、84 gNaHCO3与MgCO3的混合物中所含氧原子数目为3NA |
| C、27gAl在 22.4L Cl2中燃烧,转移的电子总数为3 NA |
| D、60 g石英晶体中含有的Si-O键数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 预期的转化 | 选择的试剂 | 实验现象 | 结论(用化学方程式表示) |
| ① | S→SO2 | 硫磺、 氧气 | -- | |
| ② | SO2→S | 二氧化硫、 硫化氢 | --- | SO2+2H2S═3S↓+2H2O |
| ③ | SO2→H2SO4 | 二氧化硫、 氯水 | 氯水退色 | |
| ④ | H2SO4→SO2 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液的导电性不一定强于弱电解质溶液的导电性 |
| B、电解质溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数 |
| C、易溶物是强电解质,难溶物一定是弱电解质 |
| D、硫酸钡在水里的溶解度很小,但溶于水的硫酸钡全部电离,所以硫酸钡是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-═I2+2OH- |
| B、高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O |
| C、AlCl3溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘化亚铁溶于稀硝酸中:3Fe2++4H++NO3-=3Fe3++NO↑+2 H2O | ||||
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | ||||
C、向沸水中滴入几滴饱和氯化铁溶液,并加热至溶液成红褐色:Fe3++3H2O
| ||||
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
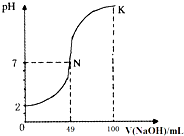 常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )| A、H2A为二元强酸 |
| B、K点时加水稀释溶液,c(H+)增大 |
| C、N点对应溶液有:c(Na+)=c(A2-)+c(HA-) |
| D、K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com