
【题目】如图所示是几种常见的化学电源示意图,有关说法不正确的是( ) 
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.铅蓄电池工作过程中,每通过 2 mol 电子,负极质量减轻 207 g
【答案】D
【解析】解:A、干电池是一次性电池,铅蓄电池是可充电电池属于二次电池,氢氧燃料电池属于燃料电池,故A正确;
B、在干电池中,Zn作负极,被氧化,故B正确;
C、氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内,且工作的最终产物是水,故氢氧燃料电池是一种具有应用前景的绿色电源,故C正确;
D、铅蓄电池工作过程中,硫酸铅在负极上析出,该极质量应该增加而非减小,故D错误;
故选:D.
A、干电池是一次性电池,铅蓄电池是可充电电池属于二次电池,氢氧燃料电池属于燃料电池;
B、干电池中锌做原电池的负极被腐蚀;
C、氢氧燃料电池的产物为水,无污染;
D、依据铅蓄电池电极反应结合电子守恒计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:

请回答下列问题:
(1) 气体D 与F 反应可生成盐,该盐的化学式为_________。
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的结构式是___________。
(3) 气体D转化为气体C 的化学方程式__________。
(4) Al 与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是_____________。
(5) Al 与NO3-在碱性条件下反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
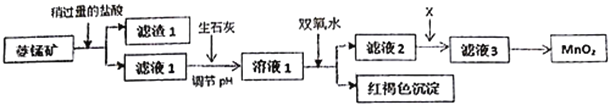
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
Ksp(CuS)=6.3×10-16 Ksp(MnS)= 3×10-14
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________________________。滤渣1的成分是_________,盐酸溶解MnCO3的离子方程式是_________________________________;
(2)用生石灰而不用NaOH调节pH的原因是_______________________________;
(3)滤液2中加入某种物质X可以除去Cu2+,最适合的是_______________;
A.MnO2 B.NaOH C.MnS
该反应的离子方程式是____________________________;
(4)将MnCl2转化为MnO2的一种方法是将酸化的NaClO3溶液氧化Mn2+,请补充并配平下列方程;____Mn2++_____ClO3-+______=____Cl2↑+____MnO2+_________;_________________
(5)将MnCl2转化为MnO2的另一种方法是电解法。(填“正极”或“负极”或“阴极”或“阳极”)
① MnO2在电解池的__________________(填“正极”或“负极”或“阴极”或“阳极”)生成;
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( ) ①放电时,Fe为正极,Ni2O3为负极;
Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( ) ①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e﹣═Fe+2OH﹣;
③充电时,Ni(OH)2为阳极;④蓄电池的电极必须浸在某碱性溶液中.
A.①②③
B.①②④
C.①③④
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气中的NO2、CO2对环境具有极大影响,利用化学反应原理对其处理,对构建“绿水青山”生态文明有重要意义。请回答下列问题:
(1)下列说法正确的是_________
A.CO2和NO2与水反应所得溶液均为弱酸
B.NO2在一定条件下能与NH3反应生成环境友好的物质
C.通过测定溶液的pH,一定能判断H2CO3和HNO2的酸性强弱
D.Na2CO3溶液中加入硫酸可生成CO2
(2)H2在催化剂存在下能与NO2反应生成水蒸气和氮气而消去工业尾气中NO2的污染,
已知:①N(g)+2O2(g)=2NO2(g)ΔH=+133kJ/mol;②H2O(g)=H2O(1)ΔH=-44kJ/mol;③H2的燃烧热为285.8kJ/mol,该反应的热化学方程式为___________.
(3)CO2可在一定条件下转化为CH3OH。己知向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂和T1温度下,发生反应:CO2(g)+3H2(g) ![]() CH3OH(1)+H2O(1)ΔH<O,10min时达到平衡状态,10min后改变温度为T2,生成物全部为气体,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(1)+H2O(1)ΔH<O,10min时达到平衡状态,10min后改变温度为T2,生成物全部为气体,20min时达到平衡状态,反应过程中部分数据见表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
0min | 2 | 6 | 0 | 0 |
10min | 4.5 | |||
20min | 1 |
①前10min内的平均反应速率v(CO2)=_______,20min时H2的转化率为_______。
②在其他条件不变的情况下,若30min时只改变温度为T3,达平衡时H2的物质的量为3.2mol,则T2______T3(填“>”“<”或“=”),在温度T2时,反应的化学平衡常数为______。
③在T1温度下,将容器容积缩小一倍,反应达平衡时CH3OH物质的量为____mol.和改变下列条件,能使H2的反应速率和转化率都一定增大的是____(填标号)。
A.在容积不变下升高温度
B.其它条件下不变,增加压强
C.在容积和温度不变下充入N2
D.在容积和温度不变下及时分离出CH3OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确且能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 配制FeCl3溶液 | 将FeCl3固体溶解于适量蒸馏水 |
B | 称取2.0gNaOH 固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g 砝码,左盘上添加NaOH 固体 |
C | 检验溶液中是否含有NH4+ | 取少最试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应平衡常数K= ![]() .恒容条件下达到平衡时,温度升高H2浓度减小.下列说法正确的是( )
.恒容条件下达到平衡时,温度升高H2浓度减小.下列说法正确的是( )
A.该反应的化学方程式为CO+H2O ![]() CO2+H2
CO2+H2
B.该反应的焓变为正值
C.恒温恒容下,增大压强,H2浓度一定减小
D.升高温度,平衡右移,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com