
【题目】设![]() 代表阿伏加德罗常数的值。下列叙述正确的是( )
代表阿伏加德罗常数的值。下列叙述正确的是( )
A.将![]() 通过
通过![]() 使其增重
使其增重![]() 时,反应中转移电子数为
时,反应中转移电子数为![]()
B.将![]() 通入到水中,则
通入到水中,则![]()
C.常温常压下,![]() 含甲醛
含甲醛![]() 的冰醋酸中含有的原子总数为
的冰醋酸中含有的原子总数为![]()
D.![]() 的
的![]() 中含有的
中含有的![]() 键数为
键数为![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】丙烯是重要的化工原料,以丙烯为原料合成有机玻璃和油墨材料DAP-A树脂的流程如下:

回答问题:
(1)写出下列物质可能的结构简式:B___________________,F________________________。
(2)写出反应类型:反应②___________________;反应③____________________________。
(3)1 mol DAP-A树脂在一定条件下与H2发生加成反应,最多消耗H2_______________mol。
(4)写出反应①的化学方程式_____________________________________________________。
(5)写出G在一定条件下与乙二醇发生反应生成一种高分子化合物的化学方程式为_______。
(6)E的同分异构体中,属于酯类的链状有机物有HCOOCH2CH=CH2、HCOOCH=CHCH3、___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在工农业生产中有着重要作用.回答下列问题
(1)工业制硫酸,接触室中发生反应的化学方程式为___________。下列可提高SO2平衡转化率的措施是___________。(填标号)
A.降低温度 B.减小压强 C.延长反应时间 D.增大O2的投料
(2)工业上可用Fe2(SO4)3溶液吸收SO2,该过程的离子方程式为________。为实现吸收液的再生,可通入_________。
(3)用如图装置脱除废烟气中的SO2和废水中的Cu2+,该方法总反应的化学方程式为___________。含Cu2+的废水应置于___________室(填“a”或“b”)。
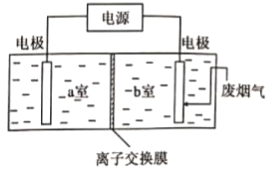
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液逐滴加入0.2mol·L1的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.1mol·L1
B. 通入CO2的体积为448mL
C. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=2∶1
D. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】38.4 mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到22.4 mL(标准状况下)气体,反应消耗的HNO3的物质的量可能是 ( )
A.1.0×10-3 molB.1.6×10-3 molC.2.2×10-3 molD.2.4×10-3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁铝合金与一定量的浓硝酸恰好完全反应,得到溶液A和![]() 、
、![]() 、NO的混合气体,这些气体与
、NO的混合气体,这些气体与![]() 标准状况
标准状况![]() 混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得溶液A中加入
混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得溶液A中加入![]() 溶液至金属离子恰好完全沉淀,则消耗NaOH溶液的体积是
溶液至金属离子恰好完全沉淀,则消耗NaOH溶液的体积是 ![]()
![]()
A.![]() B.80mLC.
B.80mLC.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少 CO 对大气的污染,某研究性学习小组拟研究 CO 和 H2O 反应转化为绿色能源H2。已知:
2CO(g)+O2(g) =2CO2(g); H=-566kJ·moL-1
2H2(g)+O2(g) =2H2O(g); H=-483.6kJ·moL-1
H2O(g) =H2O(l); H=-44.0kJ·moL-1
(1)表示氢气燃烧热的化学方程式中 △H=__________。
(2)写出CO和 H2O(g)作用生成 CO2 和 H2 的热化学方程式____________________________________________。
(3)往 1L 体积不变的容器中加入 0.200mol CO 和 1.00mol H2O(g),在 t℃时反应并达到平衡,若该反应的化学平衡常数 K=1(方程式中各物质前化学计量数为最简比),则 t℃时 CO 的转化率为____;反应达到平衡后,升高温度,此时平衡常数将__________ (填“变大”、 “不变”或“变小”),平衡将向__________ (填“正”或“逆”)方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的M、X、Y、Z、W五种短周期元素,其中X、Y、Z、W同周期,![]() 与
与![]() 具有相同的电子层结构,M与W形成的化合物是形成酸雨的主要成分,Y与Z的最外层电子数之和等于X与W的最外层电子数之和。下列说法不正确的是
具有相同的电子层结构,M与W形成的化合物是形成酸雨的主要成分,Y与Z的最外层电子数之和等于X与W的最外层电子数之和。下列说法不正确的是![]()
A.X、M两种元素能形成具有强氧化性的离子化合物
B.简单离子半径:![]()
C.M的最简单氢化物的热稳定性一定比Z的强
D.Y元素的简单离子可以促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O
(1)上述溶液中,可发生水解的是______(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为:_______________。
(3)向④中加入少量氯化铵固体,此时![]() 的值________(填“增大”、“减小”、或“不变”)。
的值________(填“增大”、“减小”、或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”)
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com