
【题目】X、Y、Z、W是第三周期元素,它们最高价氧化物对应的水化物溶于水,得到浓度均为0.010mol/L的溶液,其pH(25℃)与对应元素原子半径的关系如图所示。下列说法正确的是( )
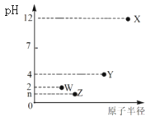
A. 简单离子的半径:X>Z>W
B. 简单气态氢化物的稳定性:Z>W>Y
C. Y单质可用于制作半导体材料
D. n =2-lg2
【答案】D
【解析】
第三周期元素中,X最高价氧化物水化物的溶液pH为12,氢氧根浓度为0.01mol/L,故为一元强碱,则X为Na;Y、W、Z对应的最高价氧化物水化物的溶液pH均小于7,均为酸,W最高价含氧酸溶液中氢离子浓度为0.01mol/L,故为一元强酸,则W为Cl元素;最高价含氧酸中,Z对应的酸性比W的强、Y对应的酸性比W的弱,而原子半径Y> Z> Cl,硅酸不溶于水,故Z为S元素,Y为P元素,以此来答题。
A.比较半径,首先看电子层数,电子层数越多,半径越大;电子层结构相同的离子,原子序数大,半径小,故离子的半径:Z>W>X,故A错误;
B.非金属性越强,气态氢化物越稳定,故简单气态氢化物的稳定性:W>Z>Y,故B错误;
C.Y为P元素,单质不可用于制作半导体材料,故C错误;
D. Z为S元素,形成的最高价氧化物对应的水化物为H2SO4,由于PH=-lgc(H+)=-lg0.02=n,故n =2-lg2,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】各物质间有着一定的转化关系,下列各组物质间可以按下图所示直接转化的是

A.Na→Na2O→Na2CO3→Na2O2B.CO→CO2→H2CO3→CO
C.NaOH→NaCl→Na2CO3→NaOHD.HCl→CuCl2→BaCl2→HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() mL 1mo/L
mL 1mo/L ![]() 和
和![]() mL 1mo/L
mL 1mo/L ![]() 两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是

A. ![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B. 在0≤pH≤5时,![]() 溶液满足
溶液满足![]()
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的![]() 和
和![]() 溶液,溶液pH:
溶液,溶液pH:![]() >
>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是![]()
![]()
A. 标准状况下,22.4LCO和CO2的混合物中,含碳原子的数目为NA
B. 14g分子式为C5H10的烃中,含有的碳碳双键的数目为0.2NA
C. 0.1mol/L的CH3COONH4溶液中,含铵根离子数目小于0.1NA
D. 标准状况下2.24LCl2通入足量水中或NaOH溶液中,转移电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:________,其中电子占据的轨道数为________个。
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为________,羟基间的相互作用力为________。
(3)不同大小的苯芳烃能识别某些离子,如:![]() 、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:______。
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于________晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_________________。
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为________,C60晶体密度的计算式为________ g·cm-3。(NA为阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
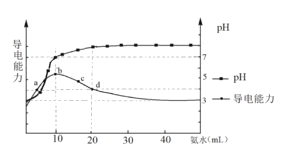
A. 各点溶液中的离子浓度总和大小关系:d>c > b > a
B. 常温下,R-的水解平衡常数数量级为10 -9
C. a点和b点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《新修本草》中关于“青矾”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽木不茂”,下列相关叙述不正确的是
A. 赤色固体可能是Fe2O3
B. 青矾宜密闭保存,防止氧化变质
C. 青矾燃烧过程中发生了电子转移
D. “青矾厂气”可能是CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
I、甲同学向1molL﹣1氯化铁溶液中加入少量的NaOH溶液;
II、乙同学直接加热饱和FeCl3溶液;
III、丙同学向25ml沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。试回答下列问题:
(1)其中操作正确的同学是___。写出此过程中的化学方程式:___;
(2)证明有Fe(OH)3胶体生成的最简单实验操作是___;
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带__电荷。
②向其中加入饱和Na2SO4溶液,产生的现象是____;
③向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为___;继续滴加,沉淀最终消失且得棕黄色溶液,写出化学方程式___;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有的![]() 和CrO42-会对水体产生很大的危害,这种工业废水必须净化处理。一种处理含铬废水的工艺流程如下:
和CrO42-会对水体产生很大的危害,这种工业废水必须净化处理。一种处理含铬废水的工艺流程如下:
![]()
下列说法不正确的是
A. ①中,酸化后发生反应为![]()
B. ②中,反应的氧化剂与还原剂的物质的量之比为3∶1
C. ③中,所得沉淀Cr(OH)3中含有Fe(OH)3
D. ③中调pH所用物质可以是NH3或Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com